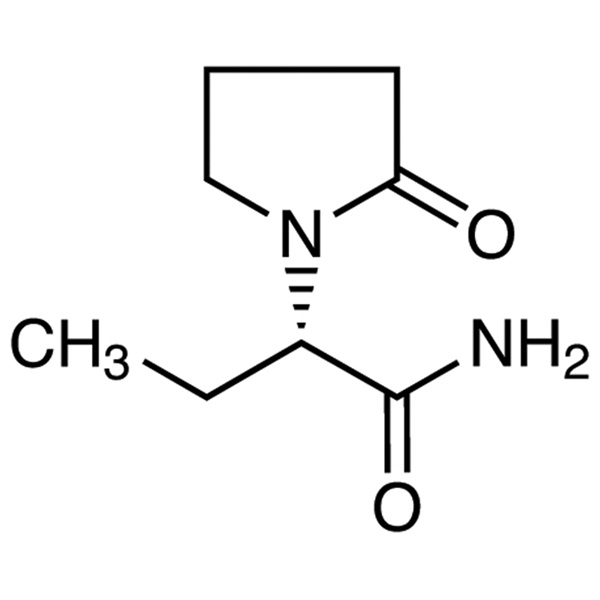
Analyse 98,0 % ~ 102,0 % de lévétiracétam LEV CAS 102767-28-2, norme USP EP
Shanghai Ruifu Chemical Co., Ltd. est le principal fabricant de lévétiracétam (CAS : 102767-28-2) de haute qualité et de qualité stable, API, norme USP/EP, médicament antiépileptique de troisième génération. Ruifu Chemical peut fournir une livraison dans le monde entier, des prix compétitifs, un excellent service, des quantités petites et en vrac disponibles. Achetez du lévétiracétam, Veuillez contacter : alvin@ruifuchem.com
| Nom chimique | Lévétiracétam |
| Synonymes | LEV; (S)-2-(2-Oxo-1-pyrrolidinyl)butyramide; UCB-L059 ; (S)-alpha-Éthyl-2-Oxo-1-Pyrrolidineacétamide ; (2S)-2-(2-Oxopyrrolidin-1-yl)butanamide |
| Numéro CAS | 102767-28-2 |
| État des stocks | En stock, capacité de production de 500 tonnes par an |
| Formule moléculaire | C8H14N2O2 |
| Poids moléculaire | 170.21 |
| Point de fusion | 116,0 ~ 119,0 ℃ |
| Densité | 1,168g/cm3 |
| Solubilité | Soluble dans l'acétone |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Origine du produit | Shanghai, Chine |
| Catégories de produits | Antiépileptique ; API (Ingrédient Pharmaceutique Actif) |
| Marque | Produit chimique Ruifu |
| Article | Spécifications |
| Apparence | Poudre de cristaux blancs ou presque blancs |
| Identification | IR |
| Apparition de la solution | Clair et pas plus intensément coloré que BY6 |
| Limite du lévétiracétam R - Énantiomère | ≤0,80% |
| Eau (par K.F) | ≤0,50% |
| Résidus à l'allumage | ≤0,10 % |
| Métaux lourds | ≤0,001% |
| Substances associées | |
| Pyridine-2-ol | ≤0,025% |
| Acide lévétiracétam | ≤0,30% |
| Composé A apparenté au lévétiracétam | ≤0,05% |
| Composé B lié au lévétiracétam | ≤0,10 % |
| Toute impureté individuelle non spécifiée | ≤0,05% |
| Total des impuretés non précisées | ≤0,10 % |
| Impuretés totales | ≤0,40% |
| Solvants résiduels | Répondre aux spécifications |
| Méthode de dosage/analyse | 98,0 % ~ 102,0 % (calculé sur une base anhydre et sans solvant) |
| Norme de test | Norme USP ; Norme PE |
| Demande | API ; Médicament antiépileptique de troisième génération |
Forfait : Bouteille, sac en papier d'aluminium, tambour de 25 kg/carton ou selon les exigences du client.
Conditions de stockage: Gardez le récipient bien fermé et stockez-le dans un entrepôt frais, sec et bien ventilé, à l'écart des substances incompatibles. Tenir à l'écart du soleil ; éviter le feu et les sources de chaleur ; éviter l'humidité.
Expédition : Livrer dans le monde entier par avion, par FedEx / DHL Express. Fournir une livraison rapide et fiable.
Lévétiracétam
C8H14N2O2 170,21
1-Pyrrolidineacétamide, -éthyl-2-oxo-, (S)-;
()-(S)--Éthyl-2-oxo-1-pyrrolidineacétamide [102767-28-2].
DÉFINITION
Le lévétiracétam contient 98,0 % de NLT et 102,0 % de NMT de C8H14N2O2, calculés sur une base anhydre et sans solvant.
IDENTIFICATION
• A. Absorption infrarouge <197K>
• B. Le temps de rétention du pic majeur du lévétiracétam de la solution échantillon correspond à celui du lévétiracétam S-énantiomère de la solution d'adéquation du système, tel qu'obtenu dans le test de limite du lévétiracétam R-énantiomère.
ESSAI
• Procédure
Tampon : 2,7 g/L de phosphate monobasique de potassium dans l'eau. Ajuster avec 2 % d’hydroxyde de potassium aqueux (p/v) à un pH de 5,5.
Solution A : Acétonitrile et tampon (1:19)
Solution B : Acétonitrile
Phase mobile : Voir le tableau des dégradés ci-dessous.
Temps (min) Solution A (%) Solution B (%)
0 100 0
3 100 0
20 71 29
Solution d’adéquation du système : 0,2 mg/mL d’USP Levetiracetam RS et 0,08 mg/mL de USP Levetiracetam Related Composé A RS dans la solution A. Préparez en dissolvant d’abord la quantité requise d’USP Levetiracetam RS dans une fiole jaugée appropriée. Ajouter 10 % du volume du ballon d’hydroxyde de potassium 0,1 N. Laisser réagir à température ambiante pendant environ 15 min, puis neutraliser en ajoutant de l'acide chlorhydrique 0,1 N à 10 % du volume du ballon. Ajouter la quantité requise de composé associé au lévétiracétam USP A RS, soniquer pour dissoudre, diluer avec la solution A au volume et mélanger.
Solution standard : 0,1 mg/mL de USP Levetiracetam RS dans la solution A
Solution échantillon : 0,1 mg/mL de lévétiracétam dans la solution A
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : LC
Détecteur : UV 205 nm
Colonne : 4,6-mm × 15-cm ; emballage L1
Débit : 0,9 mL/min
Taille de l'injection : 10 µL
Adéquation du système
Exemple : Solution d'adéquation du système
[Remarque-Les temps de rétention relatifs sont indiqués dans le tableau des impuretés 1.]
Exigences d'aptitude
Écart type relatif : NMT 1,0 %
[Remarque-Si les critères d'adéquation du système ne peuvent pas être remplis, il est recommandé de maintenir la température de la colonne à 20 °C pour stabiliser le système.]
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de C8H14N2O2 dans la portion de Lévétiracétam prise :
Résultat = [(rU/rS) × (CS/CU) × 100] F
rU = réponse maximale du lévétiracétam de la solution échantillon
rS = réponse maximale du lévétiracétam de la solution étalon
CS = concentration de USP Lévétiracétam RS dans la solution étalon (mg/mL)
CU = concentration de Lévétiracétam dans la solution échantillon (mg/mL)
F = pourcentage de lévétiracétam R-énantiomère du test pour la limite du lévétiracétam R-énantiomère
Critères d'acceptation : 98,0%-102,0% sur base anhydre et sans solvant
IMPURETÉS
Impuretés inorganiques
• Résidu au feu<281> : NMT 0,1 %
• Métaux lourds, méthode II<231> : 20 ppm
Impuretés organiques
• Procédure 1 : Limite du composé B apparenté au lévétiracétam
[Remarque - Effectuez ce test uniquement si le composé B lié au lévétiracétam est une impureté de processus connue.]
Tampon : 1,22 g de 1-décanesulfonate de sodium dans 1 L d'eau contenant environ 1,3 mL d'acide phosphorique. Ajuster avec 20 % (p/v) d’hydroxyde de potassium jusqu’à un pH de 3,0.
Phase mobile : Acétonitrile et Tampon (3:17)
Solution d’adéquation du système : 2 mg/mL de composé apparenté USP Lévétiracétam B RS en phase mobile
Solution étalon : 0,002 mg/mL de composé apparenté USP Lévétiracétam B RS en phase mobile
Solution échantillon : 2,0 mg/mL de Lévétiracétam en phase mobile
Système chromatographique
(Voir Chromatographie 621, Adéquation du système.)
Mode : LC
Détecteur : UV 200 nm
Colonne : 4,6-mm × 25-cm ; emballage L1
Débit : 1,0 mL/min
Taille d'injection
Adéquation du système : 10 µL
Analyse : 50 µL
Adéquation du système
Exemple : Solution d'adéquation du système
[Remarque - Le temps de rétention du composé B lié au lévétiracétam est de 9 minutes.]
Exigences d'aptitude
Facteur de queue : NMT 3.0
[Remarque - Si une traînée significative du pic du composé B lié au lévétiracétam est observée (supérieure à 3,0), il est recommandé de maintenir la température de la colonne à 27 pour stabiliser le système.]
Écart type relatif : NMT 2,0 %
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de composé B lié au lévétiracétam dans la portion de lévétiracétam prise :
Résultat = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = réponse maximale du composé B lié au lévétiracétam de la solution échantillon
rS = réponse maximale du composé B lié au lévétiracétam de la solution standard
CS = concentration du composé apparenté USP Lévétiracétam B RS dans la solution étalon (mg/mL)
CU = concentration de Lévétiracétam dans la solution échantillon (mg/mL)
Mr1 = poids moléculaire de la base libre du composé B apparenté au lévétiracétam, 102,1
Mr2 = poids moléculaire du composé B apparenté au lévétiracétam, 138,6
Critères d'acceptation : NMT 0,10 %
[Remarque - La quantité de composé B apparenté au lévétiracétam mesurée doit être incluse dans le total des impuretés dans le test des impuretés organiques, procédure 2.]
• Procédure 2
Tampon, solution A, solution B, phase mobile, solution d'adéquation du système et système chromatographique : procédez comme indiqué dans le test.
Solution étalon : 0,005 mg/mL de USP Levetiracetam RS dans la solution A
Solution échantillon : 5 mg/mL de lévétiracétam dans la solution A
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de chaque impureté dans la portion de Lévétiracétam prise :
Résultat = (rU/rS) × (CS/CU) × (1/F) × 100
rU = réponse maximale de chaque impureté de la solution échantillon
rS = réponse maximale du lévétiracétam de la solution étalon
CS = concentration de USP Lévétiracétam RS dans la solution étalon (mg/mL)
CU = concentration de Lévétiracétam dans la solution échantillon (mg/mL)
F = facteur de réponse relatif (voir tableau des impuretés 1)
[Remarque-Ignorez tout pic avec un temps de rétention relatif de 0,19 ou moins.]
Critères d'acceptation
Impuretés individuelles : Voir le tableau des impuretés 1.
Impuretés totales : NMT 0,4 %
Tableau d'impuretés 1
Nom Temps de rétention relatif Facteur de réponse relatif Critères d’acceptation, NMT (%)
Pyridine-2-ol a 0,37 1,0 0,025
Lévétiracétam acideb 0,62 1,2 0,3
Lévétiracétam 1,00 - -
Composé apparenté au lévétiracétam Ac 1,25 0,35 0,05
Toute impureté individuelle non précisée - 1,0 0,05
a Non inclus dans la limite totale d'impuretés.
b (S)-2-(2-Oxopyrrolidin-1-yl)acide butanoïque. Inclus dans la limite totale d'impuretés.
c (S)-N-(1-Amino-1-oxobutan-2-yl)-4-chlorobutanamide. Inclus dans la limite totale des impuretés uniquement si le composé B lié au lévétiracétam est une impureté de procédé connue.
TESTS SPÉCIFIQUES
• Détermination de l'eau, méthode Ia<921> : NMT 0,5 %
• Limite du Lévétiracétam R-Énantiomère
Phase mobile : n-Hexane et alcool déshydraté (4:1)
Solution d’adéquation du système : 0,1 mg/mL de mélange racémique USP Levetiracetam RS en phase mobile
Solution étalon : 0,05 mg/mL de USP Levetiracetam RS en phase mobile
Solution échantillon : 10 mg/mL de Lévétiracétam en phase mobile
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : LC
Détecteur : UV 215 nm
Colonne : 4,6-mm × 25-cm ; 10-µm emballage L51
Débit : 1,0 mL/min
Taille de l'injection : 20 µL
Adéquation du système
Exemple : Solution d'adéquation du système
[Remarque - Les temps de rétention relatifs du lévétiracétam R-énantiomère et du lévétiracétam S-énantiomère sont respectivement de 0,55 et 1,0.]
Exigences d'aptitude
Résolution : NLT 4.0 entre le R- et S-énantiomères
[Remarque-Si une perte de résolution (inférieure à 4,0) est observée, il est recommandé de maintenir la température de la colonne à 25 pour stabiliser le système.]
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de lévétiracétam R-énantiomère dans la portion de lévétiracétam prise :
Résultat = (rU/rS) × (CS/CU) × 100
rU = réponse maximale du lévétiracétam R-énantiomère de la solution échantillon
rS = réponse maximale du lévétiracétam de la solution étalon
CS = concentration de USP Lévétiracétam RS dans la solution étalon (mg/mL)
CU = concentration de Lévétiracétam dans la solution échantillon (mg/mL)
Critères d'acceptation : NMT 0,8 %
EXIGENCES SUPPLÉMENTAIRES
• Conditionnement et stockage : Conserver dans des contenants bien fermés et conserver à température ambiante.
• Normes de référence USP<11>
USP Lévétiracétam RS
USP Lévétiracétam Mélange racémique RS
Un mélange 1:1 de lévétiracétam S-énantiomère-(2S)-2-(2-oxopyrrolidin-1-yl)butanamide et de lévétiracétam R-énantiomère (2R)-2-(2-oxopyrrolidin-1-yl)butanamide.
USP Lévétiracétam Composé apparenté A RS
(S)-N-(1-Amino-1-oxobutan-2-yl)-4-chlorobutanamide.
C8H14ClNO3 207,65
USP Lévétiracétam Composé apparenté B RS
(S)-2-Chlorhydrate d'aminobutanamide.
C4H10N2O·HCl 138,6

Le lévétiracétam (CAS : 102767-28-2), un dérivé du pilacétam, est un nouveau médicament antiépileptique de troisième génération approuvé par la FDA américaine en 1999. Il était initialement utilisé pour le traitement d'appoint des crises partielles chez l'adulte. En 2005, le lévétiracétam a été approuvé sous forme de comprimés et de solutions orales pour le traitement d'appoint des crises partielles chez les enfants âgés de 4 ans et plus. Il est principalement utilisé pour le traitement additif des crises partielles chez l'adulte et l'enfant de plus de 4 ans, et peut également être utilisé uniquement pour les crises partielles et les crises systémiques chez l'adulte. Il a également un certain effet curatif sur l'épilepsie myoclonique chez les adolescents, l'épilepsie réfractaire, l'épilepsie absente chez les enfants et l'épilepsie persistante.