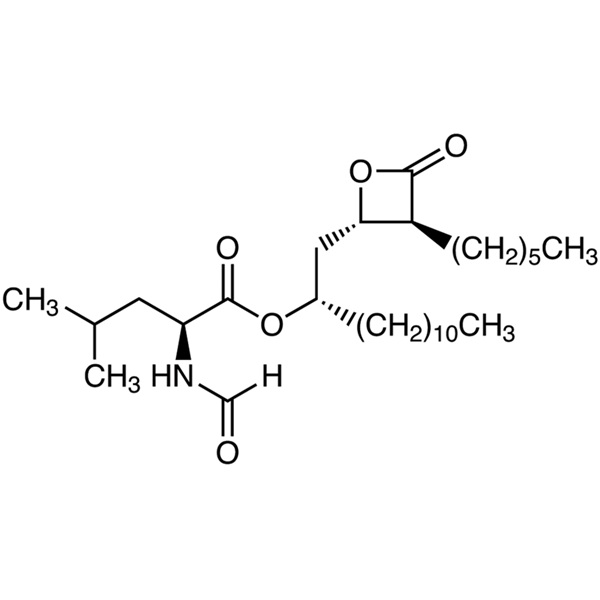
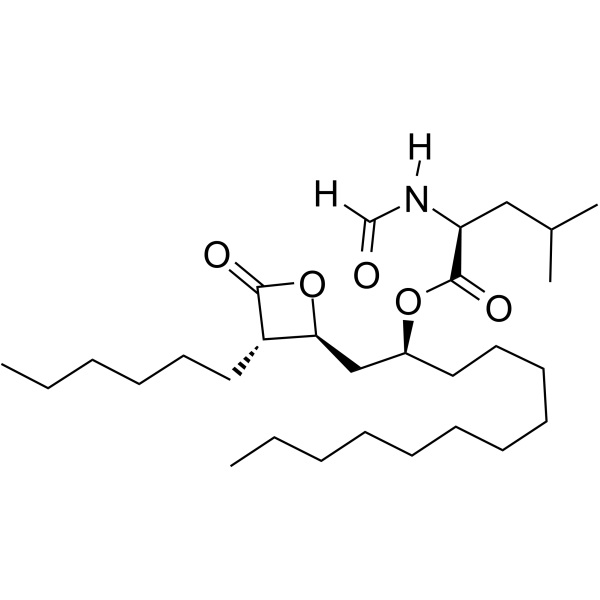
Pureté 98.0~101.5% de drogue de perte de poids d'Orlistat CAS 96829-58-2 API
Shanghai Ruifu Chemical Co., Ltd. est le principal fabricant d'Orlistat (CAS : 96829 - 58 - 2) avec une production commerciale de haute qualité et un médicament de perte de poids. Ruifu Chemical peut fournir une livraison dans le monde entier, des prix compétitifs, un excellent service, des quantités petites et en vrac disponibles. Achetez Orlistat, Veuillez contacter : alvin@ruifuchem.com
| Nom chimique | Orlistat |
| Synonymes | N-Formyl-L-Leucine (1S)-1-[[(2S,3S)-3-Hexyl-4-Oxo-2-Oxetanyl]Méthyl]Dodécyl Ester ; (S)-2-Formylamino-4-Méthyl-Acide pentanoïque (S)-1-[[(2S,3S)-3-Hexyl-4-Oxo-2-Oxetanyl]Méthyl]-Dodécyl Ester ; Tétrahydrolipstatine ; Ro-18-0647 |
| Numéro CAS | 96829-58-2 |
| État des stocks | En stock, production pouvant atteindre des tonnes |
| Formule moléculaire | C29H53NO5 |
| Poids moléculaire | 495,75 |
| Point de fusion | 43,0 ℃ ~ 48,0 ℃ |
| Densité | 0,976 ± 0,06 g/cm3 |
| Sensible | Sensible à la chaleur |
| Solubilité | Soluble dans le chloroforme |
| Conditions d'expédition | À température ambiante |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Marque | Produit chimique Ruifu |
| Article | Spécifications |
| Apparence | Poudre cristalline blanche ou presque blanche |
| Identification A | Absorption infrarouge |
| Identification B | Le temps de rétention du pic principal de la solution échantillon correspond à celui de la solution standard, tel qu'obtenu dans le test. |
| Pureté / Méthode d'analyse | 98,0 ~ 101,5 % de C29H53NO5, calculé sur une base anhydre et sans solvant |
| Rotation spécifique | -48,0° ~ -51,0° |
| Détermination de l'eau | ≤0,20% |
| Résidus à l'allumage | ≤0,10 % |
| Métaux lourds | ≤20 ppm |
| Composé A lié à l’orlistat | ≤0,20% |
| Composé B lié à l’orlistat | ≤0,05% |
| Formylleucinea | ≤0,20% |
| Composé C lié à l’orlistat | ≤0,05% |
| Orlistat Epimère à anneau ouvert | ≤0,20% |
| D-Leucine Orlistat | ≤0,20% |
| Impureté individuelle non identifiée | ≤0,10 % |
| Composé D lié à l’orlistat | ≤0,20% |
| Orlistat Anneau Ouvert Amide | ≤0,10 % |
| Composé E lié à l’orlistat | ≤0,20% |
| Impuretés totales | ≤1,00% |
| Norme de test | Pharmacopée chinoise ; USP35 |
| Utilisation | Ingrédient pharmaceutique actif (API) |
Forfait : Bouteille, sac en papier d'aluminium, tambour de 25 kg/carton ou selon les exigences du client.
Conditions de stockage : Gardez le récipient bien fermé et stockez-le dans un entrepôt frais, sec (2 ~ 8 ℃) et bien ventilé, à l'écart des substances incompatibles. Éloignez-vous de la lumière forte, de la chaleur et de l'humidité.
Expédition : Livraison dans le monde entier par avion, par FedEx / DHL Express. Fournir une livraison rapide et fiable.

L'Orlistat est une nouvelle forme de médicament amaigrissant reconnue internationalement. Son nom commercial est Sainike et a été mis en vente pour la première fois en Nouvelle-Zélande en 1998. L'Orlistat est un inhibiteur spécifique de lipase gastro-intestinale à long terme et très efficace, et il est insoluble dans l'eau, soluble dans le chloroforme et facilement soluble dans l'éthanol. L'Orlistat peut être utilisé en clinique pour traiter l'obésité. Habituellement, une dose de 120 mg est prise trois fois par jour dans l’heure qui suit un repas. La perte de poids commence à se produire après deux semaines d'utilisation. Il peut être utilisé en continu pendant 6 à 12 mois et ses effets cesseront d’augmenter une fois que la dose quotidienne dépasse 400 mg. Ce médicament peut être utilisé en combinaison avec un régime hypocalorique par les personnes obèses et en surpoids, et il peut également être utilisé comme traitement à long terme pour les patients qui ont été confrontés à des facteurs de risque liés au poids. Orlistat a un effet de contrôle du poids à long terme qui réduit et maintient le poids et empêche le rebond. L'utilisation d'Orlistat peut réduire l'apparition de facteurs de risque et de maladies liés au poids, notamment l'hypercholestérolémie, le diabète de type 2, l'intolérance au glucose, l'hyperinsulinémie et l'hypertension, et peut réduire la teneur en graisses dans les organes. L'orlistat ajuste également les taux de lipides sanguins : il peut diminuer les triglycérides sériques (TG) et le cholestérol des lipoprotéines de basse densité (LDL-C), et il peut augmenter le rapport entre les lipoprotéines de haute densité et les lipoprotéines de basse densité chez les patients obèses.
Orlistat
C29H53NO5 495,73
l-Leucine, N-formyl-, 1-[(3-hexyl-4-oxo-2-oxetanyl)methyl]dodécyl ester, [2S-[2(R*), 3]]-;
N-Formyl-l-leucine, ester avec (3S,4S)-3-hexyl-4-[(2S)-2-hydroxytridecyl]-2-oxetanone [96829-58-2].
DÉFINITION
Orlistat contient 98,0 % de NLT et 101,5 % de NMT de C29H53NO5, calculés sur une base anhydre et sans solvant.
IDENTIFICATION
• A. Absorption infrarouge <197M>
• B. Le temps de rétention du pic principal de la solution échantillon correspond à celui de la solution standard, tel qu'obtenu dans le test.
ESSAI
• Procédure
[Remarque-Évitez d'utiliser des flacons en plastique pour la préparation ou le confinement de toute solution dans cette analyse. ]
Phase mobile : Acétonitrile, acide phosphorique et eau (860 : 0,05 : 140)
Solution étalon : 0,5 mg/mL d'USP Orlistat RS en phase mobile. Injecter immédiatement après la préparation ou conserver à 5 heures.
Solution échantillon : 0,5 mg/mL d’Orlistat en phase mobile. Injecter immédiatement après la préparation ou conserver à 5 heures.
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : LC
Détecteur : UV 195
Colonne : 3,9-mm × 15-cm ; 4-µm emballage L1
Débit : 1,0 mL/min
Taille de l'injection : 20 µL
Adéquation du système
Échantillon : Solution étalon
Exigences d'aptitude
Écart type relatif : NMT 2,0 %
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage d'orlistat (C29H53NO5) dans la portion d'Orlistat prélevée :
Résultat = (rU/rS) × (CS/CU) × 100
rU = réponse maximale de la solution échantillon
rS = réponse maximale de la solution standard
CS = concentration d'USP Orlistat RS dans la solution étalon (mg/mL)
CU = concentration d'Orlistat dans la solution échantillon (mg/mL)
Critères d'acceptation : 98,0%-101,5% sur base anhydre, sans solvant-
IMPURETÉS
Impuretés inorganiques
• Résidu au feu<281> : NMT 0,1 %
• Métaux lourds, méthode II<231> : 20 ppm
Impuretés organiques
• Procédure 1 : Limite du composé A lié à l'Orlistat
Solution étalon : 0,1 mg/mL de composé apparenté A RS USP Orlistat dans de l'acétone
Solution échantillon : 50 mg/mL d’Orlistat dans de l’acétone
Système chromatographique
(Voir Chromatographie<621>, Chromatographie en couche mince.)
Mode : CCM
Adsorbant : couche de 0,25-mm de mélange de gel de silice chromatographique
Volume d'application : 10 µL
Système de solvant de développement : Toluène et acétate d'éthyle (4:1)
Solution de détection : Transférer 2,5 g d'acide phosphomolybdique et 1 g de sulfate cerrique dans une fiole jaugée de 100 - mL, dissoudre et diluer avec du méthanol jusqu'au volume.
Analyse
Échantillons : solution standard et solution échantillon
Retirez la plaque et séchez-la soigneusement à l'air libre. Vaporisez la plaque séchée avec la solution de détection et placez la plaque dans une étuve à 120° pendant 30 min.
Critères d'acceptation : Toute tache secondaire de la solution échantillon correspondant au composé A lié à l'orlistat n'est pas plus intense que la tache correspondante de la solution standard (0,2 %).
• Procédure 2 : Limite du composé B lié à l'Orlistat
Solution étalon : 0,025 mg/mL de composé apparenté à l'orlistat USP B RS dans du chlorure de méthylène
Solution échantillon : 50 mg/mL d’Orlistat dans du chlorure de méthylène
Solution d'échantillon enrichie : 50 mg/mL d'Orlistat dans une solution étalon
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : GC
Détecteur : ionisation de flamme
Colonne : 0,32-mm x 30-m de silice fondue, recouverte d'une phase stationnaire G27 de 0,25-µm
Température de la colonne : Voir le tableau du programme de température ci-dessous.
Température initiale () Rampe de température (/min) Température finale () Temps de maintien à la température finale (min)
50 4 170 -
170 30 300 30
Température
Injecteur : 270
Détecteur : 280
Gaz porteur : Hélium
Débit : 30 mL/min
Rapport de partage : 10:1
Taille de l'injection : 2 µL
Adéquation du système
Échantillon : Solution étalon
Exigences d'aptitude
Écart type relatif : NMT 10,0 %
Analyse
Échantillons : solution échantillon et solution échantillon enrichie
Calculez le pourcentage de composé B lié à l’orlistat dans la portion d’Orlistat prise :
Résultat = [rU/(rSP rU)] × (CS/CT) × 100
rU = réponse maximale du composé B lié à l'orlistat à partir de la solution échantillon
rSP = réponse maximale du composé B lié à l'orlistat de la solution échantillon enrichie
CS = concentration du composé apparenté USP Orlistat B RS dans la solution étalon (mg/mL)
CT = concentration d'Orlistat dans la solution échantillon enrichie (mg/mL)
Critères d'acceptation : NMT 0,05 % du composé B lié à l'orlistat est trouvé.
• Procédure 3
[Remarque-Évitez d'utiliser des flacons en plastique pour la préparation ou le confinement de toute solution dans cette analyse. ]
Phase mobile, solution étalon et solution échantillon : préparer comme indiqué dans le test.
Solution d'adéquation du système : 10 µg/mL d'USP Orlistat RS, 0,1 µg/mL de composé associé à l'USP Orlistat C RS et 0,25 µg/mL de composé associé à l'USP Orlistat D RS en phase mobile
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Procédez comme indiqué dans le test, sauf pour chromatographier la solution d'adéquation du système.
Adéquation du système
Exemple : Solution d'adéquation du système
Exigences d'aptitude
Rapport signal-sur-bruit : NLT 3 pour les pics du composé C lié à l'orlistat et du composé D lié à l'orlistat
Écart type relatif : NMT 10,0 % pour le pic de l'orlistat
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de chaque impureté dans la portion d’Orlistat prélevée :
Résultat = (rU/rS) × (CS/CU) × (1/F) × 100
rU = réponse maximale pour chaque impureté individuelle de la solution échantillon
rS = réponse maximale de l'USP Orlistat RS de la solution étalon
CS = concentration d'USP Orlistat RS dans la solution étalon (mg/mL)
CU = concentration d'Orlistat dans la solution échantillon (mg/mL)
F = facteur de réponse relatif tel qu'indiqué dans le tableau des impuretés 1
Critères d'acceptation : Voir le tableau d'impuretés 1.
Tableau d'impuretés 1
Nom Temps de rétention relatif Facteur de réponse relatif Critères d’acceptation, NMT (%)
Formyleucinea 0,10 4,0 0,2
Composé apparenté à l'orlistat C 0,13 33 0,05
Orlistat épimère à anneau ouvert 0,44 1,0 0,2
Composé apparenté à l'orlistat D* 0,90 - Calculé en
Procédure 4
Orlistat anneau ouvert amidec* 0,90 - Calculé en
Procédure 4
Orlistat 1,00 - -
d-Leucine orlistatd 1,18 1,0 0,2
Impureté individuelle non identifiée - 1,0 0,1
* Coélutes dans ce système LC, déterminés à l'aide de la procédure 4.
une N-Formyl-l-leucine.
b (2S,3R,5S)-5-[(S)-2-Formylamino-4-méthyl-pentanoyloxy]-2-hexyl-3-hydroxy-acide hexadécanoïque.
c N-Formyl-l-leucine (S)-1-[(2S,3S)-2-hydroxy-3-[1-phényl-R-éthylcarbomoyl]nonyl]-dodécyle ester.
d N-Formyl-d-leucine (S)-1-[[(2S,3S)-3-hexyl-4-oxo-2-oxetanyl]méthyl]dodécyl ester ou énantiomère.
• Procédure 4 : Limite du composé D lié à l'Orlistat
Phase mobile : Méthanol et eau (83:17)
Solution d'adéquation du système : 4 mg/mL d'USP Orlistat RS et 2,4 µg/mL de USP Orlistat Related Compound D RS dans l'acétonitrile, respectivement
Solution étalon : 5,0 mg/mL d'USP Orlistat RS dans de l'acétonitrile
Solution échantillon : 5,0 mg/mL d'Orlistat dans de l'acétonitrile
Système chromatographique
(Voir Chromatographie 621, Adéquation du système.)
Mode : LC
Détecteur : 205 nm
Colonne : 4,0-mm × 25-cm ; 5-µm emballage L7
Débit : 0,6 mL/min
Taille de l'injection : 20 µL
Adéquation du système
Exemple : Solution d'adéquation du système
Exigences d'aptitude
Rapport signal-sur-bruit : NLT 3 pour le pic du composé D lié à l'orlistat
Écart type relatif : NMT 10,0 % pour le pic de l'orlistat
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de chaque impureté dans la portion d’Orlistat prélevée :
Résultat = (rU/rS) × (CS/CU) × (1/F) × 100
rU = réponse maximale pour chaque impureté individuelle de la solution échantillon
rS = réponse maximale pour USP Orlistat RS de la solution standard
CS = concentration d'USP Orlistat RS dans la solution étalon (µg/mL)
CU = concentration d'Orlistat dans la solution échantillon (µg/mL)
F = facteur de réponse relatif obtenu dans le tableau d'impuretés 2
Critères d'acceptation : Voir le tableau d'impuretés 2.
Tableau d'impuretés 2
Nom Temps de rétention relatif Facteur de réponse relatif Critères d’acceptation, NMT (%)
Composé apparenté à l’orlistat D 0,94 1,0 0,2
Orlistat 1,00 - -
Orlistat amidéa à anneau ouvert 1,25 4,3 0,1
un ester de N-formyl-l-leucine (S)-1-[(2S,3S)-2-hydroxy-3-[1-phényl-R-éthylcarbomoyl]nonyl]-dodécyle.
• Procédure 5 : Limite du composé E lié à l'Orlistat
Tampon : solution de borate 0,4 N, ajustée à un pH de 10,2
Agent de dérivation : solution d'o-Phthaldéhyde (OPA). [Remarque - S'il n'est pas possible de l'obtenir dans le commerce, l'agent de dérivitisation peut être préparé à raison de 1 % chacun d'acide 3-mercaptopropionique et d'o-phtaldialdéhyde dans une solution tampon de borate 0,4 M.]
Solution A : Transférer 4,1 g d’acétate de sodium trihydraté et 40 mg d’acide éthylènediaminetétraacétique (EDTA) dans une fiole jaugée de 1-L. Dissoudre dans 950 ml d'eau et ajuster avec de l'hydroxyde de sodium 0,1 N à un pH de 7,2. Diluer avec de l'eau jusqu'au volume, ajouter 2,5 mL de tétrahydrofurane et mélanger. Filtrer et dégazer.
Solution B : Transférer 2,7 g d’acétate de sodium trihydraté et 40 mg d’EDTA dans une fiole jaugée de 1-L. Dissoudre dans 200 ml d'eau et ajuster avec de l'hydroxyde de sodium 0,1 N à un pH de 7,2. Ajouter 800 ml d'acétonitrile, filtrer et dégazer.
Phase mobile : Voir le tableau des dégradés ci-dessous.
Temps (min) Solution A (%) Solution B (%)
0 96,7 3,3
20 60 40
24 0 100
38 0 100
38 96,7 3,3
45 96,7 3,3
Solution standard : Transférer une quantité pesée d'environ 0,2 mg du composé E RS associé à l'Orlistat USP dans un flacon de 20 ml d'espace de tête. Ajouter 10 ml d'hydroxyde de sodium 4 N et fermer le flacon. Chauffer le flacon à 100°C pendant 1 h, puis laisser refroidir à température ambiante. Transférer 2 ml de la solution obtenue dans une fiole jaugée de 50 - ml et diluer avec de l'eau jusqu'au volume. À 0,5 ml de cette solution, ajoutez 2,0 ml de tampon et 0,5 ml d'agent dérivé.
Solution échantillon : procédez comme indiqué pour la solution standard, mais utilisez plutôt 25 mg d'Orlistat pour remplacer les 0,2 mg de composé associé à l'Orlistat USP E RS.
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : LC
Détecteur : Fluorescence 340 nm (excitation) ; 450 nm (émission)
Colonnes
Garde : 2,1-mm × 2-cm ; 50-µm emballage L1
Analytique : 2,1-mm × 20-cm ; emballage L1
Débit : 0,5 mL/min
Taille de l'injection : 20 µL
Adéquation du système
Échantillon : Solution étalon
Exigences d'aptitude
Écart type relatif : NMT 6,0 % pour le pic du composé E lié à l'orlistat
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de cette impureté dans la portion d'Orlistat prélevée :
Résultat = (rU/rS) × (CS/CU) × 100
rU = réponse maximale pour le composé E lié à l'orlistat dans la solution échantillon
rS = réponse maximale pour le composé associé à l'Orlistat USP E RS dans la solution étalon
CS = concentration du composé apparenté USP Orlistat E RS dans la solution étalon (mg/mL)
CU = concentration d'Orlistat dans la solution échantillon (mg/mL)
Critères d'acceptation
Impureté individuelle : NMT 0,2 % du composé E lié à l'orlistat est trouvé.
Impuretés totales : NMT 1,0 % des impuretés totales sont trouvées, les résultats des procédures 1, 2, 3, 4 et 5 étant ajoutés.
TESTS SPÉCIFIQUES
• Rotation optique, rotation spécifique <781>
Solution d'échantillon : 30 mg/mL dans de l'alcool déshydraté
Critères d'acceptation : Entre -48,0 et -51,0, à 20
• Détermination de l'eau, méthode Ic<921> : NMT 0,2 %
EXIGENCES SUPPLÉMENTAIRES
• Conditionnement et stockage : Conserver dans des récipients bien fermés entre 2 et 8℃.
• Normes de référence USP<11>
USP Orlistat RS
Composé A RS lié à l'Orlistat USP
Composé B RS lié à l'Orlistat USP
Composé C RS lié à l'Orlistat USP
Composé D RS lié à l'Orlistat USP
Composé E RS lié à l'Orlistat USP
USP35