Norme API USP de l'analyse 98.0~102.0% de Valsartan CAS 137862-53-4
Ruifu Chemical est le principal fournisseur de valsartan (CAS : 137862-53-4) de haute qualité, peut répondre à la norme USP/EP. Ruifu Chemical fournit des API et des intermédiaires pharmaceutiques depuis plus de 15 ans.
Ruifu Chemical peut fournir une livraison dans le monde entier, des prix compétitifs et un excellent service.
Acheter du Valsartan et des intermédiaires associés, veuillez nous contacter par e-mail : alvin@ruifuchem.com
| Nom chimique | Valsartan |
| Synonymes | N-Valéryl-N-[2'-(1H-tétrazol-5-yl)biphényl-4-ylméthyl]-L-valine |
| Numéro CAS | 137862-53-4 |
| État des stocks | En stock, production pouvant atteindre des tonnes |
| Formule moléculaire | C24H29N5O3 |
| Poids moléculaire | 435.52 |
| Point de fusion | 116,0 ~ 117,0 ℃ |
| Densité | 1,212 ± 0,06 g/cm3 |
| Stabilité | Hygroscopique |
| Solubilité | Soluble dans le méthanol |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Origine | Shanghai, Chine |
| Catégories de produits | API (Ingrédient Pharmaceutique Actif) |
| Marque | Produit chimique Ruifu |
| Éléments de test | Spécifications | Résultats |
| Apparence | Poudre cristalline blanche à presque blanche | Poudre cristalline blanche |
| Identification | ||
| IR | Doit être conforme à la norme de référence | Conforme |
| HPLC | Doit être conforme à la norme de référence | Conforme |
| Absorbance (420 mm) | ≤0,02 % (λ=420 nm, C=0,05 g/ml, L=1 cm) | 0,012% |
| Eau (par K.F) | ≤1,00% | 0,20% |
| Résidus à l'allumage | ≤0,10 % | 0,06% |
| Métaux lourds | ≤0,001% | <0,001% |
| Substances associées | ||
| Composé A | ≤1,00% | 0,37% |
| Composé B | ≤0,20% | 0,02% |
| Composé C | ≤0,10 % | Non détectable |
| Toute autre impureté individuelle | ≤0,10 % | 0,02% |
| Impuretés totales | ≤0,30 % (hors R-Isomère) | 0,07% |
| Solvants résiduels (GC) | ||
| Méthanol | ≤3000ppm | 693 ppm |
| Acétate d'éthyle | ≤5000ppm | 3013 ppm |
| N,N-Diméthylformamide | ≤880 ppm | Non détectable |
| Toluène | ≤890 ppm | 8 ppm |
| Méthode de dosage/analyse | 98,0 ~ 102,0 % (calculé sur l'anhydre Base, Solvant-Base Libre) | 99,7% |
| Norme de test | USP 37 | Conforme |
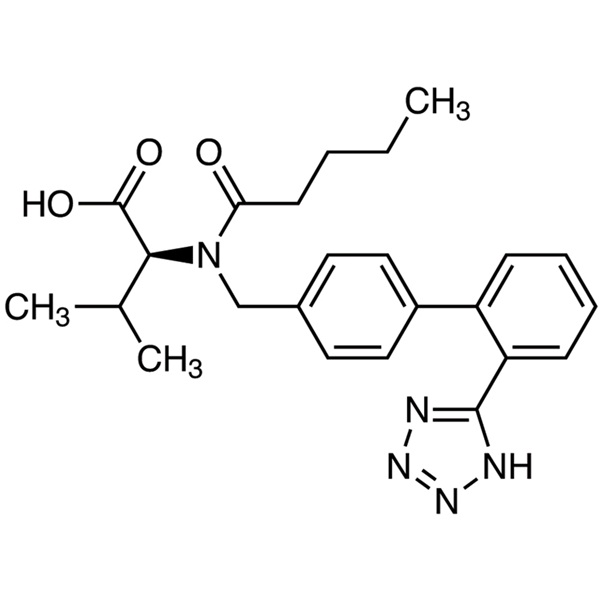
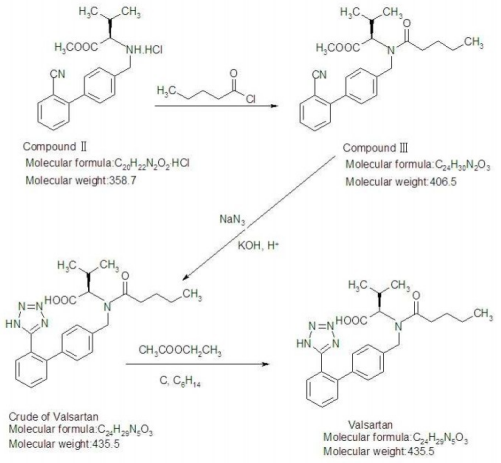
Valsartan
C24H29N5O3 435,52
l-Valine, N-(1-oxopentyl)-N-[[2'-(1H-tétrazol-5-yl)[1,1'-biphényl]-4-yl]méthyl]-.
N-[p-(o-1H-Tétrazol-5-ylphényl)benzyl]-N-valéryl-l-valine [137862-53-4].
Le valsartan ne contient pas moins de 98,0 pour cent et pas plus de 102,0 pour cent de C24H29N5O3, calculé sur une base anhydre.
Conditionnement et stockage-Conserver dans des contenants hermétiques, et conserver à 25 heures, excursions autorisées entre 15 et 30 heures. Protéger de l'humidité et de la chaleur.
Normes de référence USP<11>-
USP Valsartan RS
Composé apparenté au valsartan USP A RS
(R-N-Valéryl-N-([2'-(1H-tétrazole-5-yl)biphén-4-yl]méthyl)valine.
C24H29N5O3 435,52
Composé B RS associé au valsartan USP
(S-N-Butyryl-N-([2'-(1H-tétrazole-5-yl)biphén-4-yl]méthyl)-valine.
C23H27N5O3 421,49
Composé apparenté au valsartan USP C RS
(S-N-Valéryl-N-([2'-(1H-tétrazole-5-yl)biphén-4-yl]méthyl)-ester benzylique de valine.
C31H35N5O3 525,64
Identification-
R : Absorption infrarouge <197 M>.
B : Le temps de rétention du pic majeur dans le chromatogramme de la préparation du test correspond à celui du chromatogramme de la préparation standard, tel qu'obtenu dans le test.
Absorbance-Préparez une solution 1 : 20 dans du méthanol et déterminez l'absorbance à 420 nm. L'absorbance divisée par la longueur du trajet ne dépasse pas 0,02.
Eau, méthode I<921> : pas plus de 2,0 %.
Résidus au feu<281> : pas plus de 0,1 %.
Métaux lourds, Méthode II<231> : 0,001 %.
Composés associés-
test 1 (limite du composé a apparenté au valsartan) -
Phase mobile-Préparez un mélange de n-hexane, 2-propanol et acide trifluoroacétique (85:15:0,1). Effectuer des ajustements si nécessaire (voir Adéquation du système sous Chromatographie 621).
Solution standard - Dissoudre une quantité pesée avec précision du composé apparenté au valsartan USP A RS dans la phase mobile et diluer quantitativement, et par étapes si nécessaire, pour obtenir une solution ayant une concentration connue d'environ 0,01 mg par ml.
Solution d'adéquation du système - Dissoudre des quantités pesées avec précision de l'USP Valsartan RS et du composé apparenté au valsartan A RS de l'USP dans la phase mobile pour obtenir une solution ayant des concentrations connues d'environ 0,04 mg par ml de valsartan et de composé apparenté au valsartan A.
Solution de test-Transférer environ 50 mg de valsartan, pesés avec précision, dans une fiole jaugée de 50 - mL, ajouter environ 40 ml de phase mobile et soniquer pendant 5 minutes. Diluer avec la phase Mobile jusqu'au volume et mélanger.
Système chromatographique (voir Chromatographie<621>)-Le chromatographe liquide est équipé d'un détecteur de 230-nm et d'une colonne de 4,6-mm × 25-cm contenant 5-µm de garnissage L40. Le débit est d'environ 0,8 ml par minute. Chromatographez la solution d'adéquation du système et enregistrez les réponses maximales comme indiqué pour la procédure : la résolution, R, entre le composé A apparenté au valsartan et le valsartan n'est pas inférieure à 2,0 ; et l'écart type relatif, déterminé à partir du pic du composé A associé au valsartan, pour les injections répétées n'est pas supérieur à 5 %.
Procédure-Injectez séparément des volumes égaux (environ 10 µL) de la solution étalon et de la solution test dans le chromatographe, enregistrez les chromatogrammes et mesurez les zones des pics majeurs. Calculez le pourcentage de composé A apparenté au valsartan dans la portion de valsartan prise par la formule :
100(CS/CU)(rU/rS)
dans laquelle CS est la concentration, en mg par mL, du composé apparenté au valsartan USP A RS dans la solution étalon ; CU est la concentration, en mg par mL, de valsartan dans la solution d'essai ; et rU et rS sont les réponses maximales pour le composé A apparenté au valsartan obtenues respectivement à partir de la solution test et de la solution standard : pas plus de 1,0 % n'est trouvé.
test 2 (limite du composé b apparenté au valsartan, du composé c apparenté au valsartan et d'autres composés apparentés) -
Phase mobile-Procédez comme indiqué dans le test.
Solution standard - Dissoudre des quantités pesées avec précision de l'USP Valsartan RS, de l'USP Valsartan Related Composé B RS et de l'USP Valsartan Related Composé C RS dans la phase mobile, et diluer quantitativement, et par étapes si nécessaire, avec la phase mobile pour obtenir une solution ayant des concentrations connues d'environ 0,001 mg de valsartan par mL, 0,001 mg de composé B apparenté au valsartan par mL et 0,001 mg de composé apparenté au valsartan. C par mL.
Solution d'essai-Transférer environ 50 mg de valsartan, pesés avec précision, dans une fiole jaugée de 100 - mL, dissoudre et diluer avec la phase mobile jusqu'au volume, puis mélanger.
Système chromatographique (voir Chromatographie<621>)-Préparer comme indiqué dans le test, sauf pour utiliser un détecteur de 225-nm. Chromatographez la solution étalon et enregistrez les réponses maximales comme indiqué pour la procédure : la résolution, R, entre le composé B apparenté au valsartan et le valsartan n'est pas inférieure à 1,8 ; l'écart type relatif, déterminé à partir des pics du composé B lié au valsartan, pour les injections répétées n'est pas supérieur à 10,0 % ; et l'écart type relatif, déterminé à partir des pics de valsartan, pour les injections répétées n'est pas supérieur à 2,0 %.
Procédure-Injectez séparément des volumes égaux (environ 10 µL) de la solution étalon et de la solution test dans le chromatographe, enregistrez les chromatogrammes et mesurez les zones des pics majeurs. Calculez le pourcentage de composé B apparenté au valsartan et de composé C apparenté au valsartan dans la portion de valsartan prise par la formule :
100(CS/CU)(ri/rS)
dans laquelle CS est la concentration, en mg par mL, du composé apparenté USP Valsartan RS approprié dans la solution étalon ; CU est la concentration, en mg par mL, de valsartan dans la solution d'essai ; ri est la réponse maximale pour l'impureté obtenue à partir de la solution d'essai ; et rS est la réponse maximale pour le composé apparenté au valsartan approprié obtenu à partir de la solution étalon. Calculez le pourcentage de chaque autre impureté dans la portion de Valsartan prise par la même formule, dans laquelle CS est la concentration, en mg par mL, de USP Valsartan RS dans la solution étalon ; rS est la réponse maximale pour le valsartan obtenue à partir de la solution étalon ; et les autres termes sont tels que définis ci-dessus : on ne trouve pas plus de 0,2 % du composé B apparenté au valsartan ; pas plus de 0,1 % du composé C apparenté au valsartan n'est trouvé ; pas plus de 0,1 % de toute autre impureté individuelle, à l'exclusion du composé A apparenté au valsartan, n'est trouvé ; et pas plus de 0,3 % des impuretés totales, à l'exclusion du composé A apparenté au valsartan, sont trouvés.
Dosage-
Phase mobile-Préparer un mélange filtré et dégazé d'eau, d'acétonitrile et d'acide acétique glacial (500 : 500 : 1). Effectuer des ajustements si nécessaire (voir Adéquation du système sous Chromatographie 621).
Préparation standard-Dissoudre une quantité précisément pesée d'USP Valsartan RS dans la phase mobile et diluer quantitativement, et par étapes si nécessaire, avec la phase mobile pour obtenir une solution ayant une concentration connue d'environ 0,5 mg par ml.
Préparation du test-Transférer environ 50 mg de valsartan, pesés avec précision, dans une fiole jaugée de 100 - mL, dissoudre et diluer avec la phase mobile jusqu'au volume, puis mélanger.
Système chromatographique (voir Chromatographie<621>)-Le chromatographe liquide est équipé d'un détecteur de 273-nm et d'une colonne de 3,0-mm × 12,5-cm contenant 5-µm de garnissage L1. Le débit est d'environ 0,4 ml par minute. Chromatographiez la préparation standard et enregistrez les réponses maximales comme indiqué pour la procédure : l'écart type relatif pour les injections répétées n'est pas supérieur à 2,0 %.
Procédure-Injectez séparément des volumes égaux (environ 10 µL) de la préparation standard et de la préparation de test dans le chromatographe, enregistrez les chromatogrammes et mesurez les zones des pics majeurs. Calculez la quantité, en mg, de C24H29N5O3 dans la portion de Valsartan prise par la formule :
100C(RU/RS)
dans laquelle C est la concentration, en mg par mL, de USP Valsartan RS dans la préparation standard ; et rU et rS sont les réponses maximales obtenues respectivement à partir de la préparation du test et de la préparation standard.
Forfait : Bouteille, sac en papier d'aluminium, tambour de 25 kg/carton ou selon les exigences du client.
Conditions de stockage : Gardez le récipient bien fermé et stockez-le dans un entrepôt frais, sec (2 ~ 8 ℃) et bien ventilé, à l'écart des substances incompatibles. Protéger de la lumière et de l'humidité.
Expédition : Livraison dans le monde entier par avion, par FedEx / DHL Express. Fournir une livraison rapide et fiable.

Symboles de danger Xi - Irritant
Codes de risque
36/37/38 - Irritant pour les yeux, les voies respiratoires et la peau.
Description de la sécurité
S26 - En cas de contact avec les yeux, rincer immédiatement et abondamment à l'eau et consulter un médecin.
S37/39 - Porter des gants appropriés et une protection des yeux/du visage
WGK Allemagne 3
RTECSYV9455000
Code SH 2933990099
Shanghai Ruifu Chemical Co., Ltd. est le principal fabricant et fournisseur de valsartan (CAS : 137862-53-4) de haute qualité. Le valsartan est un antagoniste non peptidique des récepteurs AT1 de l'angiotensine II, antihypertenseur, qui a le potentiel pour la recherche sur l'hypertension artérielle et l'insuffisance cardiaque.
Les effets antihypertenseurs du valsartan sont plus forts que ceux de l’énalapril et conviennent au traitement de l’hypertension, de l’hypertension primaire légère à modérée, et en particulier de l’hypertension secondaire causée par une atteinte rénale. Il peut réduire considérablement la protéinurie chez les patients hypertendus atteints de diabète ou de fonctions hépatiques normales, et il peut favoriser l'acide urique et le sodium urinaire pour protéger les reins. Le valsartan convient également pour réduire la mortalité cardiovasculaire chez les patients à haut risque (insuffisance ou dysfonctionnement ventriculaire gauche) après une crise cardiaque.