Candésartan CAS 139481 - 59 - 7 Pureté > 99,0 % (HPLC) Usine
Intermédiaire de Candesartan Cilexetil d'approvisionnement chimique de Ruifu avec la grande pureté
Candésartan Cilexétil CAS 145040-37-5
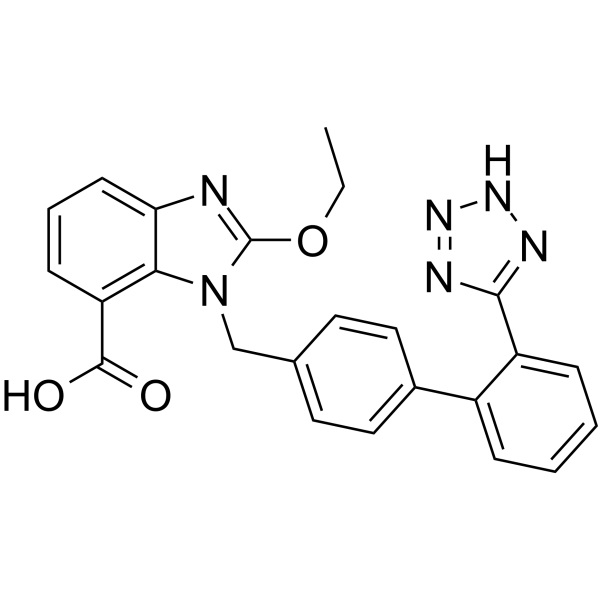
Candésartan CAS 139481-59-7
1-Carbonate de chloroéthylcyclohexyle CAS 99464-83-2
Ester éthylique intermédiaire C6 CAS 139481-41-7 de candésartan cilexétil
Candésartan Cilexétil Intermédiaire CAS 139481-44-0
Trityl Candésartan Cilexétil CAS 170791-09-0
| Nom chimique | Candésartan |
| Synonymes | CV-11974; 2-Éthoxy-1-[[2'-(1H-tétrazol-5-yl)[1,1'-biphényl]-4-yl]méthyl]-1H-Benzimidazole-7-Acide carboxylique ; 3-[[2'-(1H-Tétrazol-5-yl)biphényl-4-yl]méthyl]-2-éthoxy-3H-Benzimidazole-4-Acide carboxylique ; Candésartan M1 ; Candésartan Cilexétil EP Impureté G |
| Numéro CAS | 139481-59-7 |
| Numéro CAT | RF-PI1889 |
| État des stocks | En stock, production pouvant atteindre des tonnes |
| Formule moléculaire | C24H20N6O3 |
| Poids moléculaire | 440.45 |
| Marque | Produit chimique Ruifu |
| Article | Spécifications |
| Apparence | Poudre blanche |
| Identification-HPLC | Le temps de rétention similaire à la norme |
| Identification-RI | Semblable à Standard |
| Pureté / Méthode d'analyse | >99,0 % (HPLC) |
| Point de fusion | 183,0 ~ 185,0 ℃ |
| Perte au séchage | <0,50% |
| Humidité (K.F) | <0,50% |
| Résidus à l'allumage | <0,50% |
| Métaux lourds | <20 ppm |
| Impureté individuelle | <1,00 % (HPLC) |
| Impuretés totales | <1,00 % (HPLC) |
| Indice de réfraction | n20/J 1,745~1,747 |
| Norme de test | Norme d'entreprise |
| Utilisation | API ; Pour le traitement de l'hypertension |
Forfait: Bouteille, sac en papier d'aluminium, tambour de 25 kg/carton ou selon l'exigence du client
Conditions de stockage :Conserver dans des récipients scellés dans un endroit frais et sec ; Protéger de la lumière et de l'humidité


Le candésartan (CAS : 139481-59-7) est un antagoniste des récepteurs de l'angiotensine II avec une CI50 de 0,26 nM. Cible : Le candésartan, récepteur de l'angiotensine II, est indiqué pour le traitement de l'hypertension. Le candésartan cilexétil a été approuvé pour la première fois en Grande-Bretagne le 29 avril 1997, puis approuvé par la Food and Drug Administration (FDA) des États-Unis le 4 juin 1998 et approuvé par l'Agence japonaise des produits pharmaceutiques et des dispositifs médicaux (PMDA) le 12 mars 1999. Il a été développé par AstraZeneca, puis commercialisé sous le nom d'Atacand par AstraZeneca en Grande-Bretagne et aux États-Unis, et commercialisé sous le nom de Blopress par Takeda en JP. Le candésartan cilexétil est un bloqueur des récepteurs de l'angiotensine II (ARA), il bloque les effets vasoconstricteurs et sécrétant de l'aldostérone de l'angiotensine II en bloquant sélectivement la liaison de l'angiotensine II au récepteur AT1 dans de nombreux tissus, tels que les muscles lisses vasculaires et la glande surrénale. Atacand est indiqué dans le traitement de l'hypertension chez les adultes et les enfants âgés de 1 à < 17 ans, de l'insuffisance cardiaque (classe II-IV de la NYHA) et est utilisé pour réduire les décès d'origine cardiovasculaire et les hospitalisations pour insuffisance cardiaque.