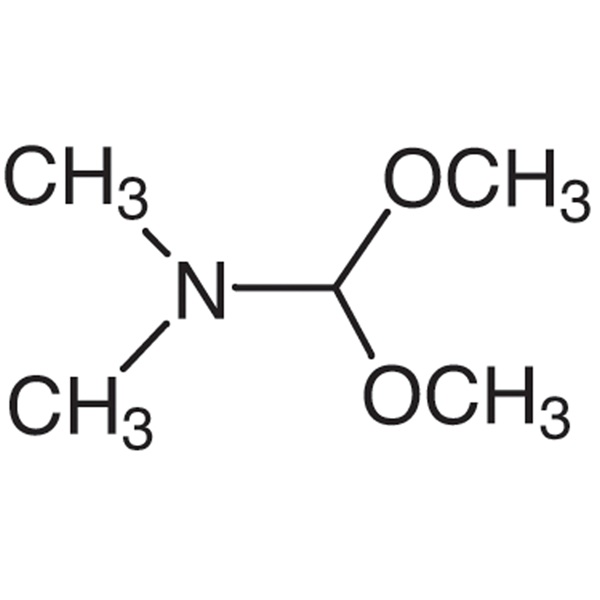
DMF - DMA CAS 4637 - 24 - 5 N, N - Diméthylformamide Diméthyl acétal Pureté > 99,0 % (GC) Vente chaude d'usine
Shanghai Ruifu Chemical est le principal fabricant de N,N-Diméthylformamide diméthylacétal (DMF-DMA) (CAS : 4637-24-5) de haute qualité. Ruifu peut fournir une livraison dans le monde entier, des prix compétitifs, un excellent service, des quantités petites et en vrac disponibles. Achetez DMF-DMA, Veuillez contacter : alvin@ruifuchem.com
| Nom chimique | N,N-Diméthylformamide Diméthylacétal |
| Synonymes | DMF-DMA ; 1,1-Diméthoxytriméthylamine; 1,1-Diméthoxy-N,N-Diméthylméthylamine; N-Diméthoxyméthyl-N,N-Diméthylamine |
| Numéro CAS | 4637-24-5 |
| État des stocks | En stock, production pouvant atteindre des tonnes |
| Formule moléculaire | C5H13NO2 |
| Poids moléculaire | 119.16 |
| Point d'ébullition | 102,0 ~ 103,0 ℃/720 mmHg (allumé.) |
| Densité spécifique (20/20) | 0,8940 à 0,8980 |
| Indice de réfraction n20/D | 1,3950 à 1,3980 (lit.) |
| Sensible | Sensible à l'humidité |
| Solubilité | Miscible avec la plupart des solvants organiques |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Marque | Produit chimique Ruifu |
| Article | Spécifications |
| Apparence | Liquide transparent incolore |
| Pureté / Méthode d'analyse | >99,0 % (GC) |
| Impuretés totales | ≤1,00% |
| Spectre infrarouge | Conforme à la structure |
| Attention | Évitez l’eau, qui peut entraîner une diminution de la pureté du produit |
| Norme de test | Norme d'entreprise |
| Utilisation | Intermédiaires pharmaceutiques |
Forfait : Bouteille, 25 kg/tambour, ou selon les exigences du client.
Conditions de stockage : Conserver dans un récipient bien fermé. Conserver dans un entrepôt frais, sec et bien ventilé, à l'écart des substances incompatibles. Protéger de la lumière et de l'humidité.
Expédition : Livraison dans le monde entier par avion, par FedEx / DHL Express. Fournir une livraison rapide et fiable.

Codes de risque
R11 - Très inflammable
R22 - Nocif en cas d'ingestion
R36/37/38 - Irritant pour les yeux, les voies respiratoires et la peau.
R36/38 - Irritant pour les yeux et la peau.
R20 - Nocif par inhalation
R20/21/22 - Nocif par inhalation, par contact avec la peau et par ingestion.
R10 - Inflammable
R52 - Nocif pour les organismes aquatiques
Description de la sécurité
S16 - Tenir à l'écart des sources d'ignition.
S26 - En cas de contact avec les yeux, rincer immédiatement et abondamment à l'eau et consulter un médecin.
S36/37 - Porter des vêtements et des gants de protection appropriés.
S36/37/39 - Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage.
S33 - Prenez des mesures de précaution contre les décharges statiques.
S29 - Ne pas vider dans les égouts.
S7/9 -
Numéros d'identification ONU UN 3271 3/PG 2
WGK Allemagne 1
CODES F DE LA MARQUE FLUKA 21
TSCA Oui
Classe de danger 3
Groupe d'emballage II
Toxicité DL50 par voie orale chez le lapin : >5000 mg/kg
Le N,N-Diméthylformamide Diméthylacétal (DMF-DMA) (CAS : 4637-24-5) a une large gamme d'applications, est un intermédiaire important dans la synthèse de composés hétérocycliques, est également un bon réactif de méthylation et un bon agent déshydratant du vinaigre, en particulier en tant qu'intermédiaires de synthèse pharmaceutique. Le DMF-DMA a été utilisé dans l'estérification méthylique de l'acide carboxylique. Le DMF-DMA est utilisé comme intermédiaire dans la formation de dérivés de pyridine. Le DMF-DMA est utilisé pour la dérivatisation des sulfamides primaires et de l'acide trifluoroacétique. Il est également utilisé dans la préparation de dérivés de formamidine. Il est utilisé comme réactif pour le n-diméthylaminométhylène et les esters méthyliques. Le DMF-DMA est utilisé pour catalyser le couplage des époxydes avec le dioxyde de carbone afin de préparer des carbonates cycliques. Le DMF-DMA est un intermédiaire du Zaleplon (CAS : 151319-34-5).
Depuis que Meenvin a rapporté la préparation du DMF-DMA (N,N-Dimethylformamide Dimethyl Acetal) en 1956, le DMF-DMA est devenu un réactif souvent utilisé en synthèse organique.
Le DMF-DMA est largement utilisé dans la construction de cycles hétérocycliques à cinq ou six chaînons dans une réaction de fermeture de cycle. Le DMF-DMA a une réaction douce et un rendement élevé, en particulier pour les composés à haute résistance.
La structure générale des composés amide-acétal est la suivante :
Le plus largement utilisé est le DMF-DMA et le DMF-DEA, l'acétal d'amide est facilement hydrolysé, peut être estérifié, amidine, alkylation et réactions de cyclisation.
L'atome de carbone central du DMF-DMA est connecté à trois hétéroatomes à grand électronégatif, ce qui lui confère une forte activité électrophile. Sous l'action de l'acide, le groupe alcoxy est facile à quitter et des ions positifs avec une activité électrophile plus forte sont obtenus. La réaction du DMF-DMA consiste principalement en une réaction de méthylation et une réaction de formation.
"One-carbon Syntheson" de DMF-DMA
Dans la réaction de fermeture de boucle impliquant le DMF-DMA, un seul atome de carbone dans le produit est souvent fourni par le DMF-DMA, le DMF-DMA peut donc être considéré comme une synthèse de carbone.
Réaction d'estérification DMF - DMA
L'estérification DMF-DMA permet à divers acides carboxyliques de générer facilement des esters d'alkyle ou d'aryle en C1-20, et les sous-produits peuvent être facilement séparés par distillation.
L'acide adipique et le DMF-DMA ont été estérifiés à 80 degrés pendant deux heures. L'amide acétal est un choix idéal pour l'estérification de certains acides carboxyliques présentant un obstacle stérique ou une mauvaise stabilité.
Réaction de l'amidination du DMF-DMA et protection des amines primaires
Les acétals d'amide peuvent réagir non seulement avec les amines primaires, mais également avec les amides, les carbamates et les sulfamides pour former des liaisons hydrocarbonées.
Tels que : 2, 4-diméthylaniline et DMF-DMA à 80 degrés peuvent rapidement éliminer le méthanol pour former des composés diméthamidine.
Le DMF-DMA peut également être utilisé comme groupe de protection contre les amines primaires, groupe de protection contre les amines primaires (2 N-H toute protection), probablement la plupart des gens pensent au phtalyle, au cycle pyrrole, au double Boc, au double PMB, etc., mais la protection DMF-DMA de l'amine primaire, dans certains cas, est également un système de protection très utile, la protection hors protection n'a besoin que d'un mélange de TFA.
Protection contre les acides aminés - 13 introduction de la base de protection commune, expérience de sélection de la base de protection, gamme d'utilisation, conditions d'introduction, partage récapitulatif des conditions de suppression
Le DMF-DMA réagit avec les groupes méthyle et méthylène actifs pour former des doubles liaisons carbone-carbone
Phénylméthylation du DMF-DMA
Réactions de composés hétérocycliques dans le DMF - DMA
L'amide acétal en tant que donneur de carbone unique peut être utilisé pour synthétiser divers composés complexes et substances naturelles biomimétiques. Avec les acétals d'amide peuvent être synthétisés : 1,2,4 triazole, 1,2, 4 triazolone, dérivés aminohétérocycliques, pyrimidine, pyrimidine, indoles, pyridine, quinoléine, thiazole, oxazolone, isooxazole, 1,2, 4-triazone, pyranone, pyrazine, pyrazine et d'autres séries de dérivés hétérocycliques d'ammoniac, peuvent également être synthétisé de l'oxygène, des composés hétérocycliques soufrés.
Selon le type de réaction chimique, l'application de l'acétal d'amide dans la synthèse de composés hétérocycliques peut être divisée en trois aspects suivants.
(1) : amide acétal et amine, amide, réaction lipidique carbamate, génèrent une variété d'anneaux hétérocycliques
Réaction d'amidoacétal et d'amine en intermédiaire formamidine, puis réaction de cycle nucléophile intramoléculaire pour générer divers hétérocycles, ou formamidine et hydrazine, hydroxylamine, l, 2, un ou deux halogénures d'alkyle contenant deux groupes actifs de composés plus une longue chaîne de carbone, puis un cycle intramoléculaire.
Synthèse de composés hétérocycliques par réaction d'acétals d'amide et d'amides, telle que la synthèse de dérivés de l, 2,4 monotriazole. Tout d'abord, l'acétal réagit avec l'amide pour former du N, N 'tritradil, puis s'anneau avec la phénylhydrazine pour former des dérivés de l, 2,4 monotriazole.
Les acétals d'amide réagissent avec l'acide carbamique ou l'acétate pour former des cycles hétérocycliques contenant du chlore. Intermédiaire diactif formé par la réaction d'un acétal d'amide avec un ester d'aminoéthyle : n.n-diméthyl-n'alkyl-carboxyméthylformamidine, qui réagit avec l'hydrazine ou l'hydrazine substituée. Par exemple, pour la préparation de 1,2,4 triazinone-6, l'équation est présentée ci-dessous. Si vous le réagissez avec un nitro-formate, vous obtenez 1,2,4 triazolone-5.
Mécanisme de réaction pour la formation de 1,2,4 triazolone-5
La composition du 1.2.4- triazolidine-5 est en deux étapes. Premièrement, le carbamate d’éthyle et les acétals de diformaldéhyde DMF forment l’intermédiaire Nn-diméthyl-n-éthoxy-formamidine. Deuxièmement, le groupe amino de la phénylhydrazine désattaque le carbone de la formamidine, qui perd -N (CH3). Ensuite, l'ammoniac sur le cycle benzénique près de la phénylhydrazine attaque le carbone du groupe carbone, formant un anion oxygène, et la paire d'électrons libres sur l'oxygène descend, perd le groupe éthoxy et produit 1,2, 4-triazolone-5.
(II) Préparation de composés hétérocycliques par réaction d'amide acétal et d'amide
Il s’agit de la méthode de synthèse d’impuretés la plus rapportée au cours des dernières décennies. L'action de l'amide acétal est équivalente au réactif de Grignard, mais les conditions de réaction de l'amide acétal sont simples et douces.
L'acétal d'amide a deux groupes actifs, une réactivité élevée et un méthyle actif, une réaction de méthylène pour former des intermédiaires d'amidine, peut être une réaction supplémentaire, une fermeture de cycle, et le réactif de Grignard et la réaction de méthylène, allongeant seulement la chaîne carbonée, ne peuvent pas être une réaction supplémentaire. Par exemple, synthèse de dérivés de furanochroone.
(3) : amide acétal et hydroxyle, réaction de composé sulfhydryle pour générer de l'oxygène, composés hétérocycliques soufrés
La synthèse ci-dessus de furohutanone est un bon exemple de la génération acétalique de dérivés énamine et de groupe hydroxyle en séparant le pôle endolatéral, ce qui donne lieu à de l'hétéramine contenant de l'oxy-. Autre exemple : catéchol et DMF -- Le DMA forme des anneaux contenant de l'oxygène en présence de dichlorométhane.
La réaction du DMF -- Le DMA et l'o-mercaptoaniline peuvent produire un hétérocycle contenant du soufre, la formule de réaction est la suivante
Étude de cas de la réaction de fermeture de l'anneau DMF-DMA et de la réaction personnelle
(1) Synthèse d'indole Batcho - Leimgruber
Préparation de divers dérivés du Vindol à partir de l'o-nitrotoluène.
Mécanisme de réaction
Tout d'abord, le diméthylformamide diméthylacétal, les ions négatifs du groupe méthoxy partent pour produire un intermédiaire plus réactif. Il est attaqué par les carboanions formés par la déprotonation de l'o-nitrotoluène méthylhydrogène et perd le méthanol pour obtenir l'énylamine susmentionnée. Le produit de cette étape, l'énamine, ressemble à un alcène avec des substituants attracteurs et donneurs d'électrons attachés des deux côtés (l'oléfine push-pull est fortement polaire et souvent rouge foncé en raison de la large plage de conjugaison dans la molécule. Dans la deuxième étape de la réaction, le groupe nitro est réduit en un groupe amino, suivi d'une cyclisation et d'une élimination pour obtenir le produit final.
(2) Images composites de dérivés de la pyridine
(3) Synthèse de dérivés du pyrazole