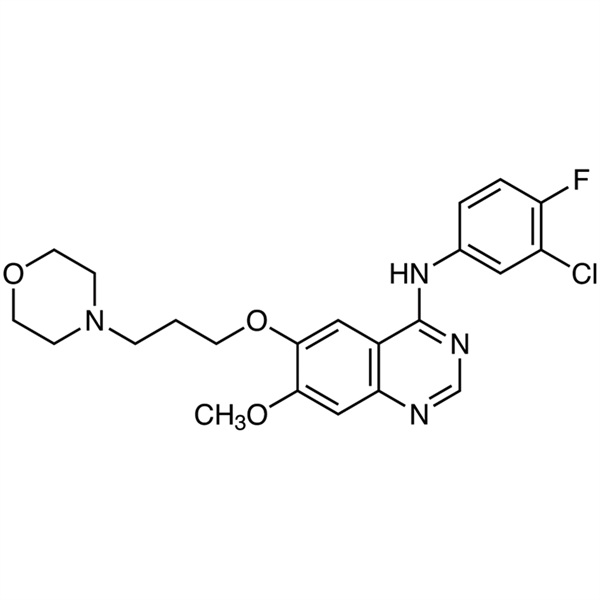
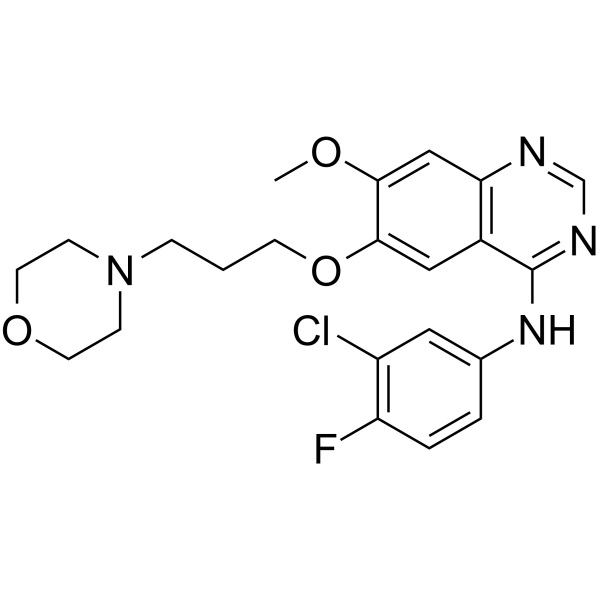
Géfitinib CAS 184475-35-2 Pureté >99,5 % (HPLC)
Shanghai Ruifu Chemical Co., Ltd. est le principal fabricant de géfitinib (CAS : 184475-35-2) de haute qualité. Ruifu Chemical peut fournir une livraison dans le monde entier, des prix compétitifs, un excellent service, des quantités petites et en vrac disponibles. Achetez du géfitinib et des intermédiaires, Veuillez contacter : alvin@ruifuchem.com
| Nom chimique | Géfitinib |
| Synonymes | Base libre de géfitinib ; Iresse ; ZD1839 ; ZD-1839 ; N-(3-Chloro-4-Fluorophényl)-7-Méthoxy-6-(3-Morpholinopropoxy)quinazolin-4-Amine; N-(3-Chloro-4-Fluorophényl)-7-Méthoxy-6-[3-(4-Morpholinyl)propoxy]-4-Quinazolinamine |
| État des stocks | En stock, production commerciale |
| Numéro CAS | 184475-35-2 |
| Formule moléculaire | C22H24ClFN4O3 |
| Poids moléculaire | 446,91 g/mol |
| Point de fusion | 194,0 à 198,0℃ |
| Densité | 1,322 ± 0,06 g/cm3 |
| Solubilité | Insoluble dans l'eau. Soluble dans le DMSO |
| Température de stockage. | Température ambiante |
| Expédition | Ambiante |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Origine | Shanghai, Chine |
| Catégories de produits | API (Ingrédient Pharmaceutique Actif) |
| Marque | Produit chimique Ruifu |
| Articles | Normes d'inspection | Résultats |
| Apparence | Blanc à Cassé - Poudre blanche | Conforme |
| Perte au séchage | <0,50% | 0,13% |
| Résidus lors de l'allumage | <0,20% | 0,06% |
| Impureté unique | <0,10% | 0,09% |
| Impuretés totales | <0,50% | 0,20% |
| Métaux lourds (Pb) | ≤10 ppm | <10 ppm |
| Pureté du géfitinib | >99,5 % (HPLC) | 99,80% |
| Spectre infrarouge | Conforme à la structure | Conforme |
| Spectre RMN 1H | Conforme à la structure | Conforme |
| Conclusion | Le produit a été testé et est conforme aux spécifications données | |
Forfait : Bouteille fluorée, sac en papier d'aluminium, fût de 25 kg/carton ou selon les exigences du client.
Conditions de stockage : Conserver le récipient bien fermé et stocker dans un entrepôt frais, sec et bien ventilé, à l'écart des substances incompatibles. Protéger de la lumière et de l'humidité.
Expédition :Livraison dans le monde entier par avion, par FedEx / DHL Express. Fournir une livraison rapide et fiable.
Ne pas utiliser chez l'homme. Ne pas utiliser à des fins diagnostiques ou thérapeutiques. Pour la recherche in vitro uniquement.
Aucun des produits ne sera fourni dans des pays dans lesquels cela pourrait être en conflit avec les brevets existants. Toutefois, la responsabilité finale incombe à l'acheteur.
Comment acheter ? Veuillez contacterDr Alvin Huang : sales@ruifuchem.com ou alvin@ruifuchem.com
15 ans d'expérience ?Nous avons plus de 15 ans d'expérience dans la fabrication et l'exportation d'une large gamme d'intermédiaires pharmaceutiques ou de produits chimiques fins de haute qualité.
Principaux marchés ? Vendre sur le marché intérieur, en Amérique du Nord, en Europe, en Inde, en Corée, au Japon, en Australie, etc.
Avantages ? Qualité supérieure, prix abordable, services professionnels et support technique, livraison rapide.
Qualité Assurance? Système de contrôle de qualité strict. Les équipements professionnels d'analyse comprennent RMN, LC-MS, GC, HPLC, ICP-MS, UV, IR, OR, K.F, ROI, LOD, MP, clarté, solubilité, test de limite microbienne, etc.
Échantillons? La plupart des produits fournissent des échantillons gratuits pour l'évaluation de la qualité, les frais d'expédition doivent être payés par les clients.
Audit d'usine? Audit d'usine bienvenu. Veuillez prendre rendez-vous à l'avance.
QUANTITÉ MINIMALE DE COMMANDE ? Aucun MOQ. La petite commande est acceptable.
Délai de livraison? Si en stock, livraison sous trois jours garantie.
Transport? Par Express (FedEx, DHL), par Air, par Mer.
Des documents ? Service après-vente : COA, MOA, ROS, MSDS, etc. peuvent être fournis.
Synthèse personnalisée? Peut fournir des services de synthèse personnalisés pour répondre au mieux à vos besoins de recherche.
Conditions de paiement? La facture pro forma sera envoyée en priorité après confirmation de la commande, accompagnée de nos coordonnées bancaires. Paiement par T/T (Transfert Télex), PayPal, Western Union, etc.
| Description de la sécurité | 24/25 - Évitez tout contact avec la peau et les yeux. |
| Code SH | 2934999099 |
Le géfitinib (CAS : 184475-35-2) est un médicament thérapeutique ciblé anti-tumoral hautement spécifique développé par AstraZeneca, Royaume-Uni. Il s'agit du premier médicament moléculaire ciblé pour le traitement du cancer du poumon non à petites cellules. Il agit en inhibant sélectivement la voie de transduction du signal de la tyrosine kinase du récepteur du facteur de croissance épidermique (EGFR - TK). Le facteur de croissance épidermique (EGF) est un polypeptide d'une masse moléculaire relative de 6,45 × 103, qui peut se combiner avec le récepteur du facteur de croissance épidermique (EGFR) sur la membrane cellulaire cible pour produire des effets biologiques. L'EGFR est un récepteur de type tyrosine kinase (TK). Lorsqu'il se lie à l'EGF, il peut favoriser l'activation des savoirs traditionnels dans le corps receveur, entraînant une autophosphorylation des résidus tyrosine du récepteur, fournissant ainsi des signaux de division continus aux cellules, provoquant la prolifération et la différenciation cellulaire. L'EGFR est abondant dans les tissus humains et est fortement exprimé dans les tumeurs malignes. En bloquant la voie de signalisation de l'EGFR à la surface des cellules, le géfitinib entrave la croissance tumorale, les métastases et l'angiogenèse, et peut induire l'apoptose des cellules tumorales. En août 2002, le géfitinib a été commercialisé pour la première fois au Japon comme traitement de première intention du cancer du poumon non à petites cellules sous le nom commercial Iressa. En mai 2003, la Food and Drug Administration des États-Unis a approuvé le géfitinib comme monothérapie de troisième intention pour les patients atteints d'un cancer du poumon non à petites cellules avancé qui étaient inefficaces avec les médicaments anticancéreux à base de platine et la chimiothérapie au docétaxel. À l'heure actuelle, il a été approuvé par l'Australie, le Japon, l'Argentine, Singapour et la Corée du Sud pour le traitement du cancer du poumon non à petites cellules avancé. Le 28 février 2005, la China Food and Drug Administration a approuvé le géfitinib pour le traitement du cancer du poumon non à petites cellules (CPNPC) localement avancé ou métastatique qui avait déjà reçu une chimiothérapie. Son utilisation n'est actuellement pas approuvée comme traitement de première intention pour le CPNPC avancé. Le 1er juillet 2009, l'Agence européenne des médicaments a officiellement approuvé le géfitinib pour le traitement de première, deuxième et troisième intention du cancer du poumon non à petites cellules localement avancé ou métastatique avec mutations du gène EGFR chez l'adulte.