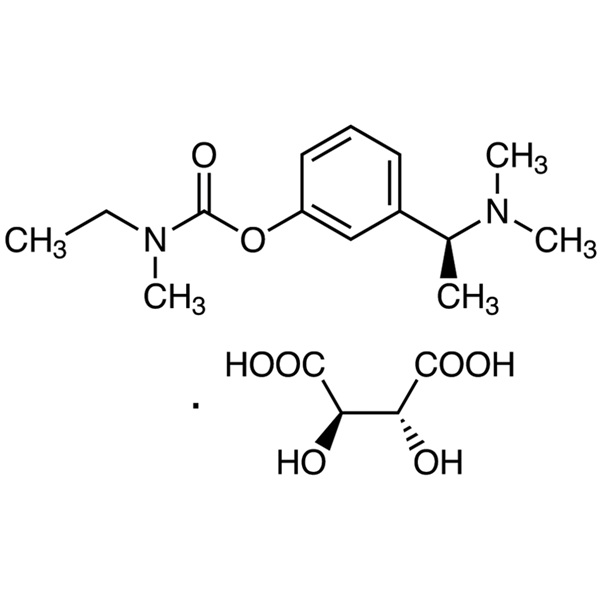
Analyse 98.0~102.0 de tartrate de rivastigmine CAS 129101-54-8
Shanghai Ruifu Chemical Co., Ltd. est le principal fabricant de tartrate de rivastigmine (CAS : 129101-54-8) de haute qualité. Ruifu Chemical peut fournir une livraison dans le monde entier, des prix compétitifs, un excellent service, des quantités petites et en vrac disponibles. Achetez du tartrate de rivastigmine, Veuillez contacter : alvin@ruifuchem.com
| Nom chimique | Tartrate de rivastigmine |
| Synonymes | Exelon ; ENA-713 ; Rivastigmine L-Tartrate ; Tartrate hydrogéné de rivastigmine ; CS-118 ; Tartrate de S-Rivastigmine ; 3-[(S)-1-(Diméthylamino)éthyl]phényl N-Éthyl-N-Méthylcarbamate L-Tartrate ; N-Éthyl-N-Acide méthylcarbamique 3-[(S)-1-(Diméthylamino)éthyl]phényl Ester L-Tartrate |
| État des stocks | En stock, production commerciale |
| Numéro CAS | 129101-54-8 |
| CAS connexe | 123441-03-2 |
| Formule moléculaire | C14H22N2O2·C4H6O6 |
| Poids moléculaire | 400,43 g/mol |
| Point de fusion | 124,0 à 128,0℃ |
| Rotation spécifique [a]20/D | +4,0° à +7,0° (C=5, méthanol) |
| Solubilité | Soluble dans le méthanol |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Origine | Shanghai, Chine |
| Marque | Produit chimique Ruifu |
| Articles | Normes d'inspection | Résultats |
| Apparence | Poudre cristalline blanche à blanc cassé | Conforme |
| Dosage | 98,0~102,0 % (sur la base anhydre) | 99,8% |
| L'eau de Karl Fischer | ≤0,50% | 0,15% |
| Résidus lors de l'allumage | ≤0,10 % | 0,07% |
| Métaux lourds (Pb) | ≤20 ppm | <10 ppm |
| Impureté phénol | ≤0,30% | <0,30% |
| DPTTA | ≤0,15% | <0,15% |
| Ni impureté | ≤0,15% | <0,15% |
| Impureté carbamate | ≤0,15% | <0,15% |
| Impureté de l'éther | ≤0,15% | <0,15% |
| Toute autre impureté | ≤0,10 % | <0,10% |
| Impuretés totales | ≤0,50% | <0,50% |
| R-Énantiomère | ≤0,30% | <0,30% |
| Spectre infrarouge | Conforme à la structure | Conforme |
| Spectre RMN 1H | Conforme à la structure | Conforme |
| Conclusion | Le produit a été testé et est conforme à la norme USP35 | |
Forfait : Bouteille fluorée, sac en papier d'aluminium, fût de 25 kg/carton ou selon les exigences du client.
Conditions de stockage : Gardez le récipient bien fermé et stockez-le dans un entrepôt frais, sec (2 ~ 8 ℃) et bien ventilé, à l'écart des substances incompatibles. Protéger de la lumière et de l'humidité.
Expédition :Livraison dans le monde entier par avion, par FedEx / DHL Express. Fournir une livraison rapide et fiable.
Tartrate de rivastigmine
C14H22N2O2·C4H6O6 400,42
Acide éthylméthylcarbamique, ester de 3-[(S)-1-(diméthylamino)éthyl]phényle, (2R,3R)-2,3-dihydroxybutanedioate ;
(S)-3-[1-(Diméthylamino)éthyl]phényléthylméthylcarbamate, hydrogénotartrate [129101-54-8].
Rivastigmine 250,34 [123441-03-2].
DÉFINITION
Le tartrate de rivastigmine contient 98,0 % de NLT et 102,0 % de NMT de la quantité indiquée de C14H22N2O2·C4H6O6, calculée sur une base anhydre.
IDENTIFICATION
• A. Absorption infrarouge <197K>
• B. Le temps de rétention du pic majeur de la solution échantillon correspond à celui de la solution d'adéquation du système, tel qu'obtenu lors du test des impuretés organiques, procédure 2 : pureté énantiomérique.
ESSAI
• Procédure
Tampon : 8,6 mg/mL de phosphate d'ammonium monobasique. Ajuster avec une solution d'ammoniaque à un pH de 7,0.
Phase mobile : Méthanol, acétonitrile et tampon (15:15:70)
Solution d’adéquation du système : 0,05 mg/mL de chacun du composé A RS USP associé à la rivastigmine et du composé USP associé à la rivastigmine B RS en phase mobile
Solution étalon : 0,2 mg/mL de tartrate de rivastigmine USP RS en phase mobile
Solution échantillon : 0,2 mg/mL de tartrate de rivastigmine en phase mobile
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : LC
Détecteur : UV 215 nm
Colonne : 4,6-mm × 25-cm ; 5-µm emballage L7
Débit : 1,2 mL/min
Taille de l'injection : 20 µL
[Remarque-Le débit peut être ajusté à 1,5 ml/min, si nécessaire, pour atteindre le temps de rétention recommandé de la rivastigmine à environ 10 min. ]
Adéquation du système
Exemples : solution d'adéquation du système et solution standard
Exigences d'aptitude
Résolution : NLT 1,5 entre le composé A apparenté à la rivastigmine et le composé B apparenté à la rivastigmine, solution d'adéquation du système
Efficacité de la colonne : plaques théoriques NLT 5000, solution standard
Facteur de queue : NMT 3.0, solution standard
Écart type relatif : NMT 2,0 %, solution standard
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de C14H22N2O2·C4H6O6 dans la portion de tartrate de rivastigmine prise :
Résultat = (rU/rS) × (CS/CU) × 100
rU = réponse maximale de la solution échantillon
rS = réponse maximale de la solution standard
CS = concentration de la solution étalon (mg/mL)
CU = concentration de la solution échantillon (mg/mL)
Critères d'acceptation : 98,0%-102,0% sur base anhydre
IMPURETÉS
Impuretés inorganiques
• Résidu au feu<281> : NMT 0,1 %
• Métaux lourds, méthode II<231> : NMT 20 ppm
Impuretés organiques
• Procédure 1
Phase mobile et solution d’adéquation du système : procédez comme indiqué dans le test.
Solution étalon : 1,0 µg/mL de tartrate de rivastigmine RS USP en phase mobile
Solution échantillon : 1,0 mg/mL de tartrate de rivastigmine en phase mobile
Système chromatographique : procéder comme indiqué dans le test.
(Voir Chromatographie<621>, Adéquation du système.)
Adéquation du système
Exemples : solution d'adéquation du système et solution standard
Exigences d'aptitude
Résolution : NLT 1,5 entre le composé A apparenté à la rivastigmine et le composé B apparenté à la rivastigmine, solution d'adéquation du système
Écart type relatif : NMT 10 %, solution standard
Analyse [Remarque-Le temps d'exécution est 8 fois le temps de rétention du pic de rivastigmine. ]
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de toute impureté individuelle dans la portion de tartrate de rivastigmine prise :
Résultat = (rU/rS) × (CS/CU) × (1/F) × 100
rU = réponse maximale pour chaque impureté de la solution échantillon
rS = réponse maximale de la solution standard
CS = concentration de tartrate de rivastigmine USP RS dans la solution étalon (mg/mL)
CU = concentration de tartrate de rivastigmine dans la solution échantillon (mg/mL)
F = facteur de réponse relatif (voir tableau des impuretés 1)
Critères d'acceptation
Impuretés individuelles : Voir le tableau des impuretés 1.
Impuretés totales : NMT 0,5 %
Tableau d'impuretés 1
| Nom | Temps de rétention relatif | Facteur de réponse relative | Critères d'acceptation NMT % |
| Tartrate | 0,18 | — | Ignorer |
| Impureté phénoliquea | 0,28 | 1.6 | 0,3 |
| AbDTTP | 0,46 | 0,83 | 0,15 |
| Ni impureté | 0,57 | 1.2 | 0,15 |
| Rivastigmine | 1.0 | 1.0 | — |
| Carbamate impur | 4.1 | 1.3 | 0,15 |
| Impureté de l'éther | 6.5 | 1.4 | 0,15 |
| Toute autre impureté | — | 1.0 | 0,1 |
un (S)-3-[1-(Diméthylamino)éthyl]phénol.
b (+) - Di - (p - toluoyl) - d - acide tartrique (composé A apparenté à la rivastigmine).
c (S)-3-[1-(Diméthylamino)éthyl]phényl diméthylcarbamate (composé B apparenté à la rivastigmine).
d 3-Nitrophényléthyl(méthyl)carbamate.
e (S)-N,N-Diméthyl-1-[3-(4-nitrophénoxy)phényl]éthanamine.
• Procédure 2 : Pureté énantiomérique
Tampon : Transférer 1,78 g de phosphate de sodium dibasique dihydraté et 1,38 g de phosphate de sodium monobasique dans une fiole jaugée de 1 000 -mL. Dissoudre et diluer avec de l'eau jusqu'au volume. Ajuster avec de l'acide phosphorique à un pH de 6,0.
Phase mobile : Transférer 20 mL d'acétonitrile et 205 µL de N,N-diméthyloctylamine dans une fiole jaugée de 1 000 - mL et diluer avec le tampon jusqu'au volume.
Solution étalon : 0,1 µg/mL de tartrate de rivastigmine R-Isomer RS USP en phase mobile
Solution de sensibilité : 0,05 µg/mL de tartrate de rivastigmine R-Isomer RS USP en phase mobile, solution standard
Solution d'adéquation du système : 100 µg/mL de tartrate de rivastigmine USP RS et 0,1 µg/mL de tartrate de rivastigmine USP R-Isomer RS en phase mobile
Solution échantillon : 100 µg/mL de tartrate de rivastigmine en phase mobile
Système chromatographique
(Voir Chromatographie<621>, Adéquation du système.)
Mode : LC
Détecteur : UV 200 nm
Colonne : 4,0-mm × 10-cm ; emballage L41
Débit : 0,5 mL/min
Taille de l'injection : 20 µL
Adéquation du système
Échantillons : solution standard, solution de sensibilité et solution d'adéquation du système
Exigences d'aptitude
Résolution : NLT 0,8 entre les pics énantiomères, solution d'adéquation du système
[Remarque-L'ordre d'élution est l'énantiomère R-, suivi du pic de rivastigmine, qui est l'énantiomère S-. ]
Rapport signal-sur-bruit : NLT 10, solution de sensibilité
Écart type relatif : NMT 10 %, solution standard
Analyse
Échantillons : solution standard et solution échantillon
Calculez le pourcentage de R-énantiomère dans la portion de tartrate de rivastigmine prise :
Résultat = (rU/rS) × (CS/CU) × 100
rU = réponse maximale de R-énantiomère de la solution échantillon
rS = réponse maximale de R-énantiomère de la solution standard
CS = concentration de R-énantiomère dans la solution étalon (µg/mL)
CU = concentration de tartrate de rivastigmine dans la solution échantillon (µg/mL)
Critères d'acceptation : NMT 0,3% du R-énantiomère
TESTS SPÉCIFIQUES
• Détermination de l'eau, méthode Ia<921> : NMT 0,5 %
EXIGENCES SUPPLÉMENTAIRES
• Conditionnement et stockage : conserver dans des contenants hermétiques et conserver à température ambiante.
• Normes de référence USP<11>
USP Tartrate de rivastigmine RS
USP Composé apparenté à la rivastigmine A RS
Di-p-toluoyl-d-(+)-acide tartrique monohydraté.
C20H20O9 404,37
USP Composé apparenté à la rivastigmine B RS
Ester de N,N-Acide diméthylcarbamique-3-[1-(diméthylamino)éthyl]phényle.
C13H20N2O2 236,32
USP Tartrate de rivastigmine R-Isomère RS
Comment acheter ? Veuillez contacterDr Alvin Huang : sales@ruifuchem.com ou alvin@ruifuchem.com
15 ans d'expérience ?Nous avons plus de 15 ans d'expérience dans la fabrication et l'exportation d'une large gamme d'intermédiaires pharmaceutiques ou de produits chimiques fins de haute qualité.
Principaux marchés ? Vendre sur le marché intérieur, en Amérique du Nord, en Europe, en Inde, en Corée, au Japon, en Australie, etc.
Avantages ? Qualité supérieure, prix abordable, services professionnels et support technique, livraison rapide.
Qualité Assurance? Système de contrôle de qualité strict. Les équipements professionnels d'analyse comprennent RMN, LC-MS, GC, HPLC, ICP-MS, UV, IR, OR, K.F, ROI, LOD, MP, clarté, solubilité, test de limite microbienne, etc.
Échantillons? La plupart des produits fournissent des échantillons gratuits pour l'évaluation de la qualité, les frais d'expédition doivent être payés par les clients.
Audit d'usine? Audit d'usine bienvenu. Veuillez prendre rendez-vous à l'avance.
QUANTITÉ MINIMALE DE COMMANDE ? Aucun MOQ. La petite commande est acceptable.
Délai de livraison? Si en stock, livraison sous trois jours garantie.
Transport? Par Express (FedEx, DHL), par Air, par Mer.
Des documents ? Service après-vente : COA, MOA, ROS, MSDS, etc. peuvent être fournis.
Synthèse personnalisée? Peut fournir des services de synthèse personnalisés pour répondre au mieux à vos besoins de recherche.
Conditions de paiement? La facture pro forma sera envoyée en priorité après confirmation de la commande, accompagnée de nos coordonnées bancaires. Paiement par T/T (Transfert Télex), PayPal, Western Union, etc.
Numéros d'identification ONU UN 2811 6.1 / PGII
WGK Allemagne 3
RTECS FA9550000
Code SH 29242990
Classe de danger 6.1
Groupe d'emballage III
Le tartrate de rivastigmine (CAS : 129101-54-8) est le tartrate de rivastigmine, un médicament destiné au traitement de la maladie d'Alzheimer. La rivastigmine est un dérivé de la physostigmine développé avec succès pour la première fois par Novartis, en Suisse. Le nom commercial est exelon, et la molécule a une structure de carbamate de benzyle, c'est un carbamate cérébral - inhibiteur sélectif de la cholinestérase, qui peut inhiber l'acétylcholinestérase et la butyrylcholinestérase en même temps, et favoriser la conduction nerveuse cholinergique en retardant la dégradation de l'acétylcholine libérée par les neurones cholinergiques. Il peut améliorer le dysfonctionnement cognitif médié par les cholinergiques, améliorant ainsi l'effet cognitif des patients atteints de la maladie d'Alzheimer. La capacité de liaison aux protéines plasmatiques de la rivastigmine est faible, elle traverse facilement la barrière hémato-encéphalique et présente un degré élevé de sélectivité cérébrale. Il peut non seulement agir sélectivement sur les zones les plus vulnérables du cortex cérébral et de l'hippocampe, mais également inhiber préférentiellement les sous-types dominants d'AChE dans le cerveau, ce qui peut réduire les effets secondaires cholinergiques périphériques tout en produisant des effets curatifs. La demi-vie du tartrate de rivastigmine dans l’organisme est courte et le temps d’action est long. Contrairement à la tacrine, ce produit a un effet inhibiteur plus fort sur l'enzyme G1 de l'hippocampe et du cortex. Il est utilisé en clinique pour traiter la démence légère à modérée d'Alzheimer, suspectée de maladie d'Alzheimer ou de maladie d'Alzheimer.
1. En tant qu'inhibiteur de l'acétylcholinestérase, le bicartrate de rivastigmine peut améliorer l'effet du relaxant musculaire succinylcholine. Par conséquent, il doit y avoir une période intermittente appropriée pour arrêter de prendre ce produit avant l’anesthésie. Ce produit doit être associé à d'autres préparations cholinergiques ou anticholinergiques et des précautions doivent être prises (voir [Interactions médicamenteuses]).
2. En raison de leurs effets pharmacologiques, les inhibiteurs de la cholinestérase peuvent avoir des effets sur la tension du nerf vague sur la fréquence cardiaque. Comme avec d'autres médicaments cholinergiques, il faut faire preuve de prudence lorsqu'il est administré à des patients souffrant d'une maladie des sinus ou d'un autre bloc cardiaque (voir Effets indésirables).
3. L’excitation du nerf cholinergique peut entraîner une augmentation de la sécrétion d’acide gastrique. Bien qu'aucune preuve d'aggravation significative des symptômes correspondants n'ait été observée au cours de la période d'essai clinique, les patients présentant un risque élevé d'ulcère gastrique, tels que ceux ayant des antécédents d'ulcère ou ceux recevant un traitement concomitant par des anti-inflammatoires non stéroïdiens, doivent être utilisés avec prudence.
4. Comme les autres inhibiteurs de la cholinestérase, les patients ayant des antécédents d'asthme ou d'autres maladies pulmonaires obstructives doivent être utilisés avec prudence.