Telmisartan CAS 144701-48-4 Analyse 99,0 % ~ 101,0 % Norme API EP de haute qualité
Shanghai Ruifu Chemical Co., Ltd. est le principal fournisseur de telmisartan (CAS : 144701-48-4) de haute qualité, peut répondre aux normes USP/EP. DMF/CEP/GMP disponibles.
Ruifu Chemical fournit des API et des intermédiaires pharmaceutiques depuis plus de 15 ans.
Ruifu Chemical peut fournir une livraison dans le monde entier, des prix compétitifs et un excellent service.
Achetez du Telmisartan et des intermédiaires associés, veuillez nous contacter par e-mail :alvin@ruifuchem.com
| Nom chimique | Telmisartan |
| Synonymes | 4'-[[4-Méthyl-6-(1-Méthyl-1H-Benzimidazol-2-yl)-2-Propyl-1H-Benzimidazol-1-yl]méthyl]biphényl-2-Acide carboxylique ; 4'-[(1,4'-Diméthyl-2'-propyl[2,6'-bi-1H-Benzimidazol]-1'-yl)méthyl]-[1,1'-Biphényl]-2-Acide carboxylique |
| Numéro CAS | 144701-48-4 |
| État des stocks | En stock, production pouvant atteindre des tonnes |
| Formule moléculaire | C33H30N4O2 |
| Poids moléculaire | 514.63 |
| Point de fusion | 261,0 ~ 263,0 ℃ |
| Solubilité dans l'eau | Insoluble |
| Stabilité | Hygroscopique |
| Conditions de stockage | 2-8℃ |
| Certificat d'authenticité et fiche signalétique | Disponible |
| Origine du produit | Shanghai, Chine |
| Catégories de produits | API (Ingrédient Pharmaceutique Actif) |
| Marque | Produit chimique Ruifu |
| Articles | Spécifications | Résultats |
| Apparence | Poudre cristalline blanche ou légèrement jaunâtre | Poudre cristalline blanche |
| Solubilité | Devrait répondre à l'exigence | Conforme |
| Identification IR | Doit correspondre à l’absorption infrarouge RS | Conforme |
| Apparition de la solution | Devrait répondre à l'exigence | Conforme |
| Substances associées | ||
| Impureté A | ≤0,15% | 0,05% |
| Impureté B | ≤0,15% | 0,02% |
| Impureté C | ≤0,20% | 0,03% |
| Impureté D | ≤0,20% | 0,05% |
| Impuretés non spécifiées : | ≤0,10 % | 0,06% |
| Impuretés totales | ≤1,00% | 0,30% |
| Solvants résiduels | ||
| Méthanol | ≤0,30% | Non détecté |
| Éthanol | ≤0,50% | 0,031% |
| Dichlorure de méthylène | ≤0,06% | Non détecté |
| n-Hexane | ≤0,029% | Non détecté |
| Ester éthylique d'acide acétique | ≤0,50% | Non détecté |
| Toluène | ≤0,089% | 0,025% |
| Acide acétique | ≤0,50% | 0,036% |
| Perte au séchage | ≤0,50% | 0,20% |
| Cendres sulfatées | ≤0,10 % | Conforme |
| Point de fusion | 261,0 ~ 263,0 ℃ | 261,5 ~ 262,1 ℃ |
| Taille des particules | 90 % Moins de 200 μm | Conforme |
| Dosage | 99,0 % ~ 101,0 % (substance séchée) | 99,9% |
| Norme de test | Conforme à la Pharmacopée Européenne 7.0 | Conforme |
Forfait : Bouteille, sac en papier d'aluminium, fût de 25 kg/carton ou selon les exigences du client.
Conditions de stockage : Gardez le récipient bien fermé. Conserver dans un entrepôt frais, sec (2-8℃) et bien ventilé, à l'écart des substances incompatibles. Tenir à l'écart du soleil ; éviter le feu et les sources de chaleur ; éviter l'humidité.
Expédition : Livrez dans le monde entier par avion, par mer, par FedEx / DHL Express. Fournir une livraison rapide et fiable.

Symboles de danger Xi - Irritant
Codes de risque 36/37/38 - Irritant pour les yeux, les voies respiratoires et la peau.
Description de sécurité S22 - Ne respirez pas la poussière.
S24/25 - Évitez tout contact avec la peau et les yeux.
S36 - Portez des vêtements de protection appropriés.
S26 - En cas de contact avec les yeux, rincer immédiatement et abondamment à l'eau et consulter un médecin.
WGK Allemagne 2
RTECS DV2037500
Code SH 2933990099
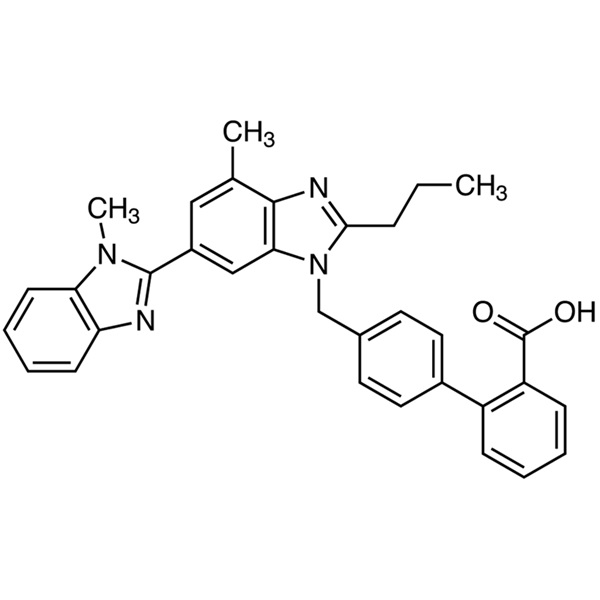
Le telmisartan (CAS : 144701-48-4) est un dérivé du benzimidazole et un antagoniste non-peptidique des récepteurs de l'angiotensine II doté de propriétés antihypertensives. Le telmisartan s'oppose sélectivement à la liaison de l'angiotensine II au récepteur du sous-type AT1, situé dans le muscle lisse vasculaire et la glande surrénale. L'antagonisme entraîne une vasodilatation et inhibe la production d'aldostérone médiée par l'angiotensine II, ce qui entraîne à son tour une diminution du sodium et de l'eau ainsi qu'une augmentation de l'excrétion de potassium conduisant à une réduction ultérieure de la pression artérielle. Le telmisartan est un nouveau type de médicaments contre l'hypertension, utilisé seul ou en association avec d'autres classes d'antihypertenseurs pour le traitement de l'hypertension. Le telmisartan a été initialement formulé par la société pharmaceutique allemande Boehringer Ingelheim ; il a obtenu le brevet allemand EP502 314 en 1991, a été approuvé pour la première fois pour entrer sur le marché américain en novembre 1998, puis est entré sur les marchés allemand, philippin, australien, belge, britannique et autres.
C33H30N4O2
Monsieur 514.6
[144701-48-4]
DÉFINITION
4′-[[4-Méthyl-6-(1-méthyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]méthyl][1,1′-biphényl]-2-acide carboxylique.
Teneur : 99,0 pour cent à 101,0 pour cent (substance séchée).
PERSONNAGES
Aspect : poudre cristalline blanche ou légèrement jaunâtre.
Solubilité : pratiquement insoluble dans l'eau, légèrement soluble dans le méthanol, peu soluble dans le chlorure de méthylène. Il se dissout dans une solution de soude R à 40 g/L.
Il montre un polymorphisme (5.9).
IDENTIFICATION
Spectrophotométrie d'absorption infrarouge (2.2.24).
Comparaison : Telmisartan CRS.
Si les spectres obtenus à l'état solide présentent des différences, dissoudre séparément la substance à examiner et la substance de référence dans de l'éthanol R anhydre chaud, évaporer à sec et enregistrer de nouveaux spectres en utilisant les résidus.
ESSAIS
Apparition de solution. La solution n'est pas plus intensément colorée que la solution de référence Y4 (2.2.2, Méthode II).
Dissoudre 0,5 g dans une solution de soude R à 40 g/L et diluer à 10 mL avec le même solvant.
Substances apparentées. Chromatographie liquide (2.2.29).
Solution d’essai. À 25 mg de la substance à examiner, ajoutez environ 5 mL de méthanol R et 100 μL d'une solution à 40 g/L d'hydroxyde de sodium R. Dissoudre par sonication et diluer à 50,0 mL avec du méthanol R.
Solution de référence (a). Diluer 1,0 mL de la solution de test à 10,0 mL avec du méthanol R. Diluer 1,0 mL de cette solution à 100,0 mL avec du méthanol R.
Solution de référence (b). Dissoudre le contenu d'un flacon de telmisartan pour vérifier l'adéquation du système CRS (contenant les impuretés A, B, C, E et F) dans 2 mL de méthanol R.
Solution de référence (c). À 5 mg de telmisartan pour l'identification du pic CRS (contenant l'impureté D), ajoutez environ 5 mL de méthanol R et 100 μL d'une solution à 40 g/L d'hydroxyde de sodium R. Dissoudre par sonication et diluer à 10 mL avec du méthanol R.
Colonne :
– taille : l = 0,125 m, Ø = 4,0 mm ;
– phase stationnaire : gel de silice octadécylsilyl coiffé pour chromatographie R (5 μm) avec une taille de pores de 10 nm ;
– température : 40 °C.
Phase mobile :
– phase mobile A : dissoudre 2,0 g de dihydrogénophosphate de potassium R et 3,8 g de pentanesulfonate de sodium monohydraté R1 dans 900 mL d'eau pour chromatographie R, ajuster à pH 3,0 avec de l'acide phosphorique dilué R et diluer à
1 000 mL avec de l'eau pour la chromatographie R ;
– phase mobile B : méthanol R1, acétonitrile pour chromatographie R (20:80 V/V) ;
Durée (min) Phase mobile A (pourcentage V/V) Phase mobile B (pourcentage V/V)
0 - 3 70 30
3 - 28 70 → 20 30 → 80
Débit : 1 mL/min.
Détection : spectrophotomètre à 230 nm.
Injection : 10 μL.
Identification des impuretés : utiliser le chromatogramme fourni avec le telmisartan pour l'adéquation du système CRS et le chromatogramme obtenu avec la solution de référence (b) pour identifier les pics dus aux impuretés A, B, C, E et F ;
utilisez le chromatogramme fourni avec le telmisartan pour l'identification du pic CRS et le chromatogramme obtenu avec la solution de référence (c) pour identifier le pic dû à l'impureté D.
Rétention relative par rapport au telmisartan
(temps de rétention = environ 15 min) : impureté A = environ 0,2 ;
impureté E = environ 0,6 ; impureté F = environ 0,7 ;
impureté B = environ 0,9 ; impureté C = environ 1,5 ;
impureté D = environ 1,6.
Adéquation du système : solution de référence (b) :
– le chromatogramme obtenu avec la solution de référence (b) est similaire au chromatogramme fourni avec le telmisartan pour l'adéquation du système CRS ;
– résolution : minimum 3,0 entre les pics dus à l'impureté B et au telmisartan.
Limites :
– impuretés C, D : pour chaque impureté, pas plus de deux fois la surface du pic principal dans le chromatogramme obtenu avec la solution témoin (a) (0,2 pour cent) ;
– impuretés A, B : pour chaque impureté, pas plus de 1,5 fois la surface du pic principal du chromatogramme obtenu avec la solution témoin (a) (0,15 pour cent) ;
– impuretés non précisées : pour chaque impureté, pas plus que la surface du pic principal dans le chromatogramme obtenu avec la solution témoin (a) (0,10 pour cent) ;
– total : pas plus de 10 fois la surface du pic principal du chromatogramme obtenu avec la solution témoin (a) (1,0 pour cent) ;
– limite de non-respect : 0,5 fois la surface du pic principal dans le chromatogramme obtenu avec la solution de référence (a) (0,05 pour cent).
Perte au séchage (2.2.32) : maximum 0,5 pour cent, déterminé sur 1 000 g par séchage dans une étuve à 105 ℃.
Cendres sulfatées (2.4.14) : maximum 0,1 pour cent, déterminé sur 1,0 g.
ESSAI
Dissoudre 0,190 g dans 5 mL d'acide formique anhydre R. Ajouter 75 mL d'anhydride acétique R. Titrer avec de l'acide perchlorique 0,1 M, en déterminant le point final par potentiométrie (2.2.20).
1 mL d'acide perchlorique 0,1 M équivaut à 25,73 mg de C33H30N4O2.
IMPURETÉS
Impuretés spécifiées : A, B, C, D.
Autres impuretés détectables (les substances suivantes, si elles sont présentes en quantité suffisante, seraient détectées par l'un ou l'autre des tests de la monographie. Elles sont limitées par le critère général d'acceptation pour les impuretés autres/non spécifiées et/ou par la monographie générale Substances à usage pharmaceutique (2034). Il n'est donc pas nécessaire d'identifier ces impuretés pour démontrer la conformité. Voir également 5.10. Contrôle des impuretés dans les substances à usage pharmaceutique) : E, F, G, H, I, J.
A. 4-méthyl-6-(1-méthyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazole,
B. 4′-[[7-méthyl-5-(1-méthyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]méthyl][1,1′-biphényl]-2-acide carboxylique,
C. tert-butyl 4′-[[4-méthyl-6-(1-méthyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]méthyl][1,1′-biphényl]-2-carboxylate,
D. structure inconnue,
E. 1-[(2′-carboxy[1,1′-biphényl]-4-yl)méthyl]-4-méthyl-2-propyl-1H-benzimidazole-6-acide carboxylique,
F. 4′-[[4-méthyl-6-(1-méthyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]méthyl][1,1′-biphényl]-2-carboxamide,
G. 4′-[[4-méthyl-6-(1-méthyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]méthyl][1,1′-biphényl]-2-carbonitrile,
H. tert-butyl 4′-(bromométhyl)[1,1′-biphényl]-2-carboxylate,
I. méthyle 4′-[(1,7′-diméthyl-2′-propyl-1H,3′H-[2,5′-bibenzimidazol]-3′-yl)méthyl][1,1′-biphényl]-2-carboxylate,
J. 4′-[(5-chloro-1,7′-diméthyl-2′-propyl-1H,3′H-[2,5′-bibenzimidazol]-3′-yl)méthyl][1,1′-biphényl]-2-acide carboxylique.